题目内容
【题目】原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是( )
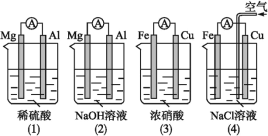
A.(1)(2)中Mg作负极,(3)(4)中Fe作负极B.(2)中Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑
C.(3)中Fe作负极,电极反应式为Fe-2e-=Fe2+D.(4)中Cu作正极,电极反应式为2H++2e-=H2↑
【答案】B
【解析】
A.(2)中的氧化还原反应发生在金属铝和氢氧化钠之间,失电子的是金属铝,Al为负极,(3)中金属铁在常温下遇浓硝酸钝化,铜做负极,故A错误;
B.(2)中的氧化还原反应发生在金属铝和氢氧化钠之间,失电子的是金属铝,Al为负极,电极反应为:Al-3e-+4OH-=AlO2-+2H2O,Mg作为正极,电极反应式为2H2O+2e-═2OH-+H2↑,故B正确;
C.(3)中铜作负极发生氧化反应,所以铜失电子生成铜离子,即电极反应式为Cu-2e-═Cu2+,故C错误;
D.铁、铜、氯化钠溶液构成的原电池中,金属铁为负极,金属铜为正极,铁发生的是吸氧腐蚀,正极上是氧气得电子的过程,电极反应式为O2+4e-+2H2O=4OH-,故D错误;
答案为B。

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目