题目内容
【题目】通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的质量确定有机物的组成.如图所示的是用燃烧法确定有机物分子式的常用装置. 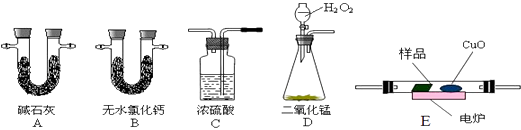
现准确称取4.4g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重8.8g,B管增重3.6g.请回答:
(1)按上述所给的测量信息,装置的连接顺序应是:(每种装置只用一次);
(2)C管中浓硫酸的作用是;
(3)要确定该有机物的分子式,还必须知道的数据是(填选项);
A.C装置增加的质量
B.样品的摩尔质量
C.CuO固体减少的质量
(4)若该有机物的相对分子质量为44,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式 , 与该有机物相对分子质量相同的烃的一氯代物有种.
【答案】
(1)DCEBA
(2)除去氧气中的水蒸气
(3)B
(4)CH3CHO;2
【解析】解:(1)D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,在E中电炉加热时用纯氧氧化管内样品,生成二氧化碳和水,如有一氧化碳生成,则E中CuO可与CO进一步反应生成二氧化碳,然后分别通入B(吸收水)、A(吸收二氧化碳)中,根据产物的质量推断有机物的组成,则产生的氧气按从左到右流向,所选置的连接顺序应是:D→C→E→B→A,
所以答案是:DCEBA;
(2.)D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,以免影响实验结果,
所以答案是:除去氧气中的水蒸气;
(3.)由上题干测量数据能够计算出该有机物的实验式,要确定有机物的分子式,还要知道有机物的相对分子质量或摩尔质量,最简式的n倍等于其摩尔质量数值,计算得到分子式,所以B正确,
所以答案是:B;
(4.)A管质量增加0.88g为二氧化碳的质量,n(CO2)=0.88g÷44g.mol﹣1=0.02mol,n(C)=n(CO2)=0.02mol,
B管质量增加0.36g是水的质量,n(H2O)=0.36g÷18g.mol﹣1=0.02mol,n(H)=2n(H2O)=0.04mol,
从而可推出含氧元素的质量为:0.44g﹣12g/mol×0.02mol﹣1g/mol×0.04mol=0.16g,n(O)= ![]() =0.01mol,
=0.01mol,
设最简式为CXHYOZ , 则n(C):n(H):n(O)=0.02mol:0.04mol:0.01mol=2:4:1,
故该物质最简式为C2H4O,
该有机物蒸气对氢气的相对分子质量为22,则该有机物的摩尔质量为:2g/mol×22=44g/mol,其相对分子量为44,
设该物质分子式为(C2H4O)n,44n=44,解得:n=1,
故该物质分子式为C2H4O,
又根据题意:它的核磁共振氢谱上有两个峰,其强度比为3:1,可推出该有机物的结构简式为:CH3CHO,与该有机物相对分子质量相同的烃为C3H8是丙烷,丙烷结构简式为CH3CH2CH3 , 则它的一氯代物有2种,
所以答案是:CH3CHO; 2.

【题目】填空题
(1)某兴趣小组甲设计了以下装置和方法测定空气中SO2含量.你认为可行的操作是(填序号)
序号 | A | B | C |
装置 |
|
|
|
原理 | 通入V升空气,测定生成沉淀的质量 | 当KMnO4溶液刚好褪色时,测定通入空气的体积V | 通入V升空气,测定U型管增加的质量 |
(2)兴趣小组乙取336mL(标准状况)某由SO2和N2组成的混合气体Y,将其通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由此推知气体Y中SO2的体积分数为 .




