题目内容
(2011?唐山模拟)[化学--选修3:物质结构与性质]W、Q、R、X、Y、Z六种元素的原子序数逐渐增大.已知W原子Is轨道上只有一个电子,Q、X原子p轨道的电子数分别为2和4,Z的原子序数为29,除Z外均为短周期主族元素,Y原子的价电子排布为msnmpn.请回答下列问题: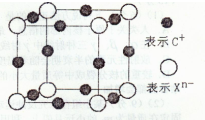
(1)Q和W能形成一种化合物的相对分子质量为28,则该化合物的中心原子采取的杂化轨道类型是
(2)Z原子的核外电子排布式为
(3)这六种元素中,电负性最大与最小的两种非金属元素形成的晶体属于
离能数值由小到大的顺序为
(4)元素X的阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示.该晶体中阳离子和阴离子个数比为

(1)Q和W能形成一种化合物的相对分子质量为28,则该化合物的中心原子采取的杂化轨道类型是
SP2
SP2
,该分子中含有1
1
个π键.(2)Z原子的核外电子排布式为
1s22s22p63s23p63d104S1
1s22s22p63s23p63d104S1
;向Z的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中Z的离子与NH3之间的化学键为配位键
配位键
.(3)这六种元素中,电负性最大与最小的两种非金属元素形成的晶体属于
原子晶体
原子晶体
晶体;Q、R、X三种元素的第一电离能数值由小到大的顺序为
C<O<N
C<O<N
(用元素符号回答).(4)元素X的阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示.该晶体中阳离子和阴离子个数比为
3:1
3:1
,晶体中每个Xn-被6
6
个等距离的C+离子包围.分析:先根据信息推导出各元素:W原子1s轨道上只有一个电子,所以W为氢,Q、X原子p轨道的电子数分别为2和4,则Q、X分别为:碳、氧;Q、R、X三种元素的原子序数逐渐增大,所以R为氮,Y价电子:msnmpn中n只能取2,又为短周期,则Y可能为C或Si,又因Y的原子序数比X(氧)大,所以Y为硅,Z的原子序数为29,则Z为铜,故可推出:W为氢,Q为碳,R为氮,X为氧,Y为硅,Z为铜.
(1)根据相对分子质量为28,确定化学式为C2H4,根据结构简式确定中心原子采取的杂化轨道类型和π键的个数;
(2)根据原子序数以及核外电子排布式的书写方法来书写,根据铜离子能与氮原子形成配位键;
(3)根据同一周期从左到右元素的电负性逐渐增强,同一主族元素从上到下元素的电负性呈减小的趋势,找出电负性最大与最小的两种非金属,然后判断出晶体的类型;根据同一周期从左到右元素的第一电离呈增大的趋势以及氮的反常现象;
(4)分别计算出阳离子和阴离子个数,然后求出两者的个数之比;根据以Xn-为中心,在X、Y、Z三个轴上,在每个轴上等距离的C+有2个,
(1)根据相对分子质量为28,确定化学式为C2H4,根据结构简式确定中心原子采取的杂化轨道类型和π键的个数;
(2)根据原子序数以及核外电子排布式的书写方法来书写,根据铜离子能与氮原子形成配位键;
(3)根据同一周期从左到右元素的电负性逐渐增强,同一主族元素从上到下元素的电负性呈减小的趋势,找出电负性最大与最小的两种非金属,然后判断出晶体的类型;根据同一周期从左到右元素的第一电离呈增大的趋势以及氮的反常现象;
(4)分别计算出阳离子和阴离子个数,然后求出两者的个数之比;根据以Xn-为中心,在X、Y、Z三个轴上,在每个轴上等距离的C+有2个,
解答:解:W原子1s轨道上只有一个电子,所以W为氢,Q、X原子p轨道的电子数分别为2和4,则Q、X分别为:碳、氧;Q、R、X三种元素的原子序数逐渐增大,所以R为氮,Y价电子:msnmpn中n只能取2,又为短周期,则Y可能为C或Si,又因Y的原子序数比X(氧)大,所以Y为硅,Z的原子序数为29,则Z为铜,故可推出:W为氢,Q为碳,R为氮,X为氧,Y为硅,Z为铜.
(1)C2H4的结构简式为CH2=CH2,中心原子C原子采取的杂化轨道类型为SP2,C-H之间单键是σ键,C=C叁键中有1个是σ键一个π键,所以分子中含有1个π键,故答案为:SP2;1;
(2)铜为29号元素,铜:1s22s22p63s23p63d104S1;因铜离子能与氮原子形成配位键,所以晶体中铜离子与NH3之间的化学键为配位键,故答案为:1s22s22p63s23p63d104S1;配位键;
(3)因同一周期从左到右元素的电负性逐渐增强,同一主族元素从上到下元素的电负性呈减小的趋势,所以电负性最强的非金属元素为N,最小的为Si,两者形成的化学式为Si3N4,为原子晶体;因同一周期从左到右元素的第一电离呈增大的趋势,碳、氮、氧的电离能呈增大趋势,但由于氮的P轨道半充满,第一电离能出现反常,比氧高,所以三种元素的第一电离能数值由小到大的顺序为:C<O<N,故答案为:原子晶体;C<O<N;
(4)一个晶胞中阳离子的个数为12×
=3,阴离子个数为:8×
=1,然后求出两者的个数之比为3:1;根据以Xn-为中心,在X、Y、Z三个轴上,在每个轴上等距离的C+有2个,共6个,故答案为:3:1;6;
(1)C2H4的结构简式为CH2=CH2,中心原子C原子采取的杂化轨道类型为SP2,C-H之间单键是σ键,C=C叁键中有1个是σ键一个π键,所以分子中含有1个π键,故答案为:SP2;1;
(2)铜为29号元素,铜:1s22s22p63s23p63d104S1;因铜离子能与氮原子形成配位键,所以晶体中铜离子与NH3之间的化学键为配位键,故答案为:1s22s22p63s23p63d104S1;配位键;
(3)因同一周期从左到右元素的电负性逐渐增强,同一主族元素从上到下元素的电负性呈减小的趋势,所以电负性最强的非金属元素为N,最小的为Si,两者形成的化学式为Si3N4,为原子晶体;因同一周期从左到右元素的第一电离呈增大的趋势,碳、氮、氧的电离能呈增大趋势,但由于氮的P轨道半充满,第一电离能出现反常,比氧高,所以三种元素的第一电离能数值由小到大的顺序为:C<O<N,故答案为:原子晶体;C<O<N;
(4)一个晶胞中阳离子的个数为12×
| 1 |
| 4 |
| 1 |
| 8 |
点评:本题考查物质结构与性质,明确位置、结构、性质的关系是解答的关键,此题综合性较强,涉及物质结构知识点比较多,考察比较全面,是一道不错的题.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
 (2011?唐山模拟)下列装置所示的实验中,能达到实验目的是( )
(2011?唐山模拟)下列装置所示的实验中,能达到实验目的是( )