题目内容
(2011?唐山模拟)已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A是组成有机物的必要元素,元素B的原子最外层电子数是其电子层数的3倍,D单质既能与强酸反应,又能与强碱反应,元素C与E形成的化合物CE是厨房常用调味品.下列说法正确的是( )
分析:A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A是组成有机物的必要元素,则A为C;元素B的原子最外层电子数是其电子层数的3倍,则电子层数为2,最外层电子数为6,所以B为O;D单质既能与强酸反应,又能与强碱反应,所以D为Al;元素C与E形成的化合物CE是厨房常用调味品,CE为NaCl,所以C为Na,E为Cl,然后结合元素及其化合物的性质来解答.
解答:解:A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A是组成有机物的必要元素,则A为C;元素B的原子最外层电子数是其电子层数的3倍,则电子层数为2,最外层电子数为6,所以B为O;D单质既能与强酸反应,又能与强碱反应,所以D为Al;元素C与E形成的化合物CE是厨房常用调味品,CE为NaCl,所以C为Na,E为Cl,
A.C、D、E的最高价氧化物对应水化物分别为NaOH、Al(OH)3、HClO4,Al(OH)3为两性氢氧化物,所以两两之间能发生反应,故A正确;
B.电解NaCl溶液得到NaOH、氢气、氯气,则电解熔融的NaCl可得到Na和氯气,故B错误;
C.C与B形成的两种化合物为Na2O、Na2O2,Na2O中只有离子键,而Na2O2中有离子键和非极性共价键,故C错误;
D.电子层越多,半径越大,同周期从左向右原子半径在减小,所以原子半径为C>D>E>A>B,故D错误;
故选A.
A.C、D、E的最高价氧化物对应水化物分别为NaOH、Al(OH)3、HClO4,Al(OH)3为两性氢氧化物,所以两两之间能发生反应,故A正确;
B.电解NaCl溶液得到NaOH、氢气、氯气,则电解熔融的NaCl可得到Na和氯气,故B错误;
C.C与B形成的两种化合物为Na2O、Na2O2,Na2O中只有离子键,而Na2O2中有离子键和非极性共价键,故C错误;
D.电子层越多,半径越大,同周期从左向右原子半径在减小,所以原子半径为C>D>E>A>B,故D错误;
故选A.
点评:本题考查原子结构与元素周期律,元素的推断是解答本题的关键,注意Al、氢氧化铝的性质、元素周期律、物质的化学键即可解答,题目难度不大.

练习册系列答案
相关题目
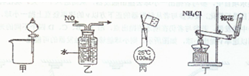 (2011?唐山模拟)下列装置所示的实验中,能达到实验目的是( )
(2011?唐山模拟)下列装置所示的实验中,能达到实验目的是( )