题目内容
20.下列关于物质性质变化的比较,不正确的是( )| A. | 酸性强弱:HI>HBr>HCl>HF | B. | 还原性强弱:F->Cl->I- | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 原子半径大小:Na>S>O |
分析 A.卤素的氢化物中,非金属性越强酸性越弱;
B.非金属性越强,阴离子的还原性越弱;
C.金属性越强,最高价氧化物对应水合物的碱性越强;
D.电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小.
解答 解:A.非金属性F>Cl>Br>I,非金属性越强,卤化氢溶液的酸性越弱,则酸性强弱为:HI>HBr>HCl>HF,故A正确;
B.非金属性F>Cl>Br>I,非金属性越强,阴离子的还原性越弱,则还原性强弱为:F-<Cl-<I-,故B错误;
C.金属性K>Na>Li,则最高价氧化物对应水合物的碱性强弱为:KOH>NaOH>LiOH,故C正确;
D.Na、S的电子层比O多1个,则O原子的原子半径最小,电子层相同时,核电荷数越大,原子半径越小,则原子半径大小为:Na>S>O,故D正确;
故选B.
点评 本题考查了元素周期律内容及应用,题目难度不大,明确元素周期律内容为解答关键,A为易错点,注意卤素的非金属性越强,氢化物水溶液的酸性越弱,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

练习册系列答案
相关题目
10.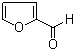 呋喃甲醛(即糠醛)的结构简式如图,其分子中的环和苯环有相似的化学性质(即有“芳香性”),则关于糠醛的叙述错误的是( )
呋喃甲醛(即糠醛)的结构简式如图,其分子中的环和苯环有相似的化学性质(即有“芳香性”),则关于糠醛的叙述错误的是( )
 呋喃甲醛(即糠醛)的结构简式如图,其分子中的环和苯环有相似的化学性质(即有“芳香性”),则关于糠醛的叙述错误的是( )
呋喃甲醛(即糠醛)的结构简式如图,其分子中的环和苯环有相似的化学性质(即有“芳香性”),则关于糠醛的叙述错误的是( )| A. | 能生成呋喃甲醇 | B. | 能生成呋喃甲酸 | ||
| C. | 能与溴水生成多种加成产物 | D. | 能与苯酚制备糠醛树脂 |
11.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1molFeCl3与沸水反应生成的胶体中含有NA个Fe(OH)3胶粒 | |
| B. | 1.12LNH3所含的原子数是0.2NA | |
| C. | 常温常压下,0.4molNa2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA | |
| D. | 1molNa2O2晶体中共含有4NA个离子 |
8.下列物质中,属于同素异形体的是( )
| A. | O2和O3 | B. | CO和CO2 | C. | 12C和13C | D. | H2O和H2O2 |
5.下列各组在溶液中进行的两个反应,可用同一离子方程式表示的是( )
| A. | CaCO3和HCl;Na2CO3和HCl | B. | BaCl2 和H2SO4;Ba(OH)2和H2SO4 | ||
| C. | HCl 和Na2CO3;HCl和NaHCO3 | D. | KOH 和H2SO4;Ba(OH)2和HNO3 |
12.下列实验方法中,正确的是( )
①在家庭中用食醋和碘化钾淀粉试纸检验食盐是否是加碘(KIO3)盐
②用酒精从碘水中萃取碘
③用加热的方法从碘和沙子的混合物中分离出碘
④实验室制Cl2、C2H4都用同一套装置
⑤用淀粉溶液直接检验I-
⑥根据加入AgNO3溶液产生白色沉淀的现象认定溶液中含Cl-
⑦盛放液溴的试剂瓶内放少量蒸馏水防止液溴的挥发
⑧用溴水鉴别C2H4和C2H6.
①在家庭中用食醋和碘化钾淀粉试纸检验食盐是否是加碘(KIO3)盐
②用酒精从碘水中萃取碘
③用加热的方法从碘和沙子的混合物中分离出碘
④实验室制Cl2、C2H4都用同一套装置
⑤用淀粉溶液直接检验I-
⑥根据加入AgNO3溶液产生白色沉淀的现象认定溶液中含Cl-
⑦盛放液溴的试剂瓶内放少量蒸馏水防止液溴的挥发
⑧用溴水鉴别C2H4和C2H6.
| A. | ①②③⑧ | B. | ③④⑥⑦ | C. | ①③⑦⑧ | D. | ②④⑥⑦ |
9.下列溶液中Cl-浓度最大的是( )
| A. | 500mL,0.2mol/L 的NaCl溶液 | B. | 1 000 mL,0.1mol/L 的MgCl2溶液 | ||
| C. | 50 mL,0.2mol/L 的CaCl2溶液 | D. | 100 mL,0.1mol/L 的AlCl3溶液 |
10.下列有关物质性质的说法正确的是( )
| A. | 热稳定性:H2S>HCl | B. | 离子半径:Na+>F- | ||
| C. | 酸性:H2SO4>HClO4 | D. | 离子还原性:S2->Cl- |
