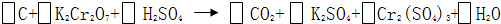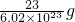题目内容
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O Cu2O+H2↑. Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(2)已知:2Cu(s)+
 O2(g)=Cu2O(s)△H=-169kJ?mol-1
O2(g)=Cu2O(s)△H=-169kJ?mol-1C(s)+
 O2(g)=CO(g)△H=-110.5kJ?mol-1
O2(g)=CO(g)△H=-110.5kJ?mol-1Cu(s)+
 O2(g)=CuO(s)△H=-157kJ?mol-1
O2(g)=CuO(s)△H=-157kJ?mol-1则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=______kJ?mol-1.
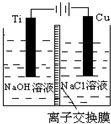
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为______.
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为______.
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:2H2O(g)
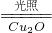 2H2(g)+O2(g)△H>0
2H2(g)+O2(g)△H>0水蒸气的浓度随时间t变化如下表所示.
| 序号 | 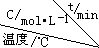 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
A.实验的温度:T2<T1
B.实验①前20min的平均反应速率 v(H2)=7×10-5 mol?L-1 min-1
C.实验②比实验①所用的催化剂催化效率高.
解:(1)方法Ⅱ用到的电解法会消耗大量的能源,且反应不易控制,并且方法Ⅲ中,肼做还原剂时会将氧化亚铜还原为金属铜,故答案为:反应不易控制,易还原产生Cu;
(2)根据盖斯定律可以得出反应2CuO(s)+C(s)=Cu2O(s)+CO(g)可以是2Cu(s)+O2(g)=2CuO(s),
2CuO(s)=2Cu(s)+O2(g)以及C(s)+ O2(g)=CO(g)三个反应的和,
O2(g)=CO(g)三个反应的和,
所以反应2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=157kJ?mol-1×2-110.5kJ?mol-1-169kJ?mol-1=34.5kJ?mol-1,
故答案为:34.5;
(3)在电解池中,当阳极是活泼电极时,该电机本身发生失电子得还原反应,在碱性环境下,金属铜失去电子的电极反应为2Cu-2e-+2OH-=Cu2O+H2O,故答案为:2Cu-2e-+2OH-=Cu2O+H2O;
(4)根据题目信息:液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,得出化学方程式为:4Cu(OH)2+N2H4 2Cu2O+N2↑+6H2O,故答案为:4Cu(OH)2+N2H4
2Cu2O+N2↑+6H2O,故答案为:4Cu(OH)2+N2H4 2Cu2O+N2↑+6H2O;
2Cu2O+N2↑+6H2O;
(5)A、实验温度越高达到化学平衡时用的时间越短,②达到平衡用30min,而①则用了40min,所以T2>T1,故A错误;
B、实验①前20min的平均反应速率 v(H2)= =
=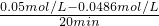 =7×10-5 mol?L-1 min-1,故B正确;
=7×10-5 mol?L-1 min-1,故B正确;
C、②③化学平衡状态未改变,反应速率加快,则是加入了催化剂,催化剂的活性越高,速率越快,在相等时间内,③中水蒸气的浓度变化比②快,故C正确.
故选BC.
分析:(1)电解法消耗大量的能源,肼还原时会将氧化亚铜还原为金属铜;
(2)根据盖斯定律来计算反应的焓变;
(3)在电解池的阳极发生失电子得还原反应;
(4)根据“液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2”来书写化学方程式;
(5)A、实验温度越高达到化学平衡时用的时间越短;
B、根据反应速率v= 来计算;
来计算;
C、催化剂不会引起化学平衡状态的改变,会使反应速率加快,活性越高,速率越快.
点评:本题是一道有关热化学、电化学以及化学反应速率和反应限度的综合题,考查角度广,难度大.
(2)根据盖斯定律可以得出反应2CuO(s)+C(s)=Cu2O(s)+CO(g)可以是2Cu(s)+O2(g)=2CuO(s),
2CuO(s)=2Cu(s)+O2(g)以及C(s)+
 O2(g)=CO(g)三个反应的和,
O2(g)=CO(g)三个反应的和,所以反应2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=157kJ?mol-1×2-110.5kJ?mol-1-169kJ?mol-1=34.5kJ?mol-1,
故答案为:34.5;
(3)在电解池中,当阳极是活泼电极时,该电机本身发生失电子得还原反应,在碱性环境下,金属铜失去电子的电极反应为2Cu-2e-+2OH-=Cu2O+H2O,故答案为:2Cu-2e-+2OH-=Cu2O+H2O;
(4)根据题目信息:液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,得出化学方程式为:4Cu(OH)2+N2H4
 2Cu2O+N2↑+6H2O,故答案为:4Cu(OH)2+N2H4
2Cu2O+N2↑+6H2O,故答案为:4Cu(OH)2+N2H4 2Cu2O+N2↑+6H2O;
2Cu2O+N2↑+6H2O;(5)A、实验温度越高达到化学平衡时用的时间越短,②达到平衡用30min,而①则用了40min,所以T2>T1,故A错误;
B、实验①前20min的平均反应速率 v(H2)=
 =
=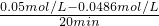 =7×10-5 mol?L-1 min-1,故B正确;
=7×10-5 mol?L-1 min-1,故B正确;C、②③化学平衡状态未改变,反应速率加快,则是加入了催化剂,催化剂的活性越高,速率越快,在相等时间内,③中水蒸气的浓度变化比②快,故C正确.
故选BC.
分析:(1)电解法消耗大量的能源,肼还原时会将氧化亚铜还原为金属铜;
(2)根据盖斯定律来计算反应的焓变;
(3)在电解池的阳极发生失电子得还原反应;
(4)根据“液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2”来书写化学方程式;
(5)A、实验温度越高达到化学平衡时用的时间越短;
B、根据反应速率v=
 来计算;
来计算;C、催化剂不会引起化学平衡状态的改变,会使反应速率加快,活性越高,速率越快.
点评:本题是一道有关热化学、电化学以及化学反应速率和反应限度的综合题,考查角度广,难度大.

练习册系列答案
相关题目
 为了研究氯水能否和碳酸钙发生化学反应,某学生设计如下实验:
为了研究氯水能否和碳酸钙发生化学反应,某学生设计如下实验: ______
______