题目内容
【题目】Ⅰ.臭氧层是地球生命的保护伞,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2![]() 2O3
2O3
(1)若在上述反应中有30%的氧气转化为臭氧,则所得混合气体的平均摩尔质量为_______。(保留一位小数)
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为____L。
Ⅱ. 标准状况下,用一定量的水吸收氨气后制得溶液浓度为17.0 mol·L-1,密度为0.90 g·mL-1的氨水,试计算1体积水吸收_______体积的氨气可制得上述氨水。(保留整数)
【答案】35.6 g·mol-1 3 623
【解析】
Ⅰ.设原有O2为1mol,计算转化的氧气与生成的臭氧的物质的量,进而计算剩余的氧气的物质的量,依据平均摩尔质量等于气体的总质量与总物质的量之比计算;用差量法计算臭氧的体积。Ⅱ.结合c=1000ρw/M来计算氨水的质量分数,再依据质量分数计算1体积水吸收氨气的体积。
Ⅰ.(1)设原有1mol O2,发生反应的O2为1mol×30%=0.3mol,由化学方程式可得:
3O2![]() 2O3
2O3
3 2
0.3 0.2
即反应生成0.2mol臭氧,则混合气的平均摩尔质量为:(32×0.7+0.2×48)/(0.7+0.2) = 35.6 g/mol。(2)设8L氧气中xL转化为臭氧,由化学方程式可得:
3O2![]() 2O3
2O3
3 2
x 2x/3
即反应生成2x/3L臭氧(原状况),由反应得到气体6.5L得关系式:(8-x) + 2x/3 = 6.5,解得x = 4.5,则生成臭氧的体积为2×4.5/3 = 3L。
Ⅱ. 氨水的浓度为c=1000ρw/M=(1000×0.90g·mL×W%)/17g·mol=17.0mol/L,解得W%=32%;设氨气体积为VL,则水为1L,氨气的物质的量为V/22.4mol,氨气的质量为17V/22.4 g, 水的质量为1000mL×1g/mL=1000g,氨水溶液质量为(1000+17V/22.4)g,则由W%=![]() ×100%= 32%解得,V=623L。
×100%= 32%解得,V=623L。

【题目】金属铬(Cr)的本意是颜色,因为它的化合物或离子都有美丽的颜色。下表是几种常见含铬的离子水溶液的颜色:
离子 | Cr2O72- | Cr(OH)4 | Cr3+ | CrO42- | Cr2+ |
颜色 | 橙色 | 绿色 | 蓝紫色 | 黄色 | 蓝色 |
(1)铬铁矿的主要成分是Fe(CrO2)2,该物质中三种元素的化合价均为整数,则Cr的化合价是_____________。
(2)向Na2CrO4溶液中加入浓盐酸,溶液会变为蓝紫色并有黄绿色气体产生,则氧化剂和还原剂的物质的量之比为_____________。
(3)向Na2Cr2O7溶液中加入浓NaOH溶液,会变成黄色,请解释原因(用离子方程式和必要的文字说明)_____________________________________________。
(4)工业上以铬铁矿[主要成分为Fe(CrO2)2,含有Al2O3、Fe2O3、SiO2等杂质]为主要原料,生产重铬酸钠晶体(Na2Cr2O7·2H2O)。主要工艺流程如下:
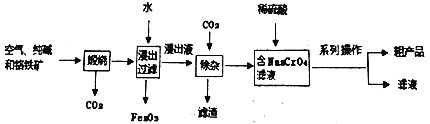
①滤渣的成分是_____________(写化学式)
②写出煅烧过程中,所发生的非氧化还原反应的化学方程式(任写一个)______________________。
③煅烧过程中,所发生的氧化还原反应如下:(其中浸出液显黄色),请完成下面化学方程式并配平。
□Fe(CrO2)2+□Na2CO3+□O2=□_________+□Fe2O3+□CO2
④工业上在重铬酸钠溶液中加入适量稀硫酸,用石墨作电极电解生产金属铬,阴极的电极反应式为__________________。