题目内容
表1.几种盐的Ksp
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| CaSO4 | 9.1×10-6 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 废水浓度 | 29.4g/L | 1.6g?L-1 |
| 排放标准 | pH 6~9 | 0.5mg?L-1 |
(2)若酸性废水中Fe3+的浓度为1.0×10-4mol?L-1,c(AsO43-)=
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降.
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为
②Ca3(AsO4)2在pH调节到8左右才开始沉淀,原因为
③砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3K2=1.7×10-7K3=4.0×10-12,
第三步电离的平衡常数的表达式为K3=
(2)依据Ksp越小,越易先生成沉淀,然后依据溶度积常数计算得到溶液的浓度;
(3)根据反应物和生成物结合元素化合价的变化配平方程式;
(4)①硫酸钙难溶于酸,所以酸性条件下能析出;
②H3AsO4是弱酸电离出来的AsO43-较少,所以酸性条件下不易形成Ca3(AsO4)2沉淀;
③H3AsO4的第三步电离式为HAsO42-?H++AsO43-,依此写出电离的平衡常数的表达式;依据水解常数与电离常数及Kw的关系计算.
| ||
| 1L |
(2)若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol?L-1,依据Ksp大小可以得到,Ksp(FeAsO4 )小,反应过程中Fe3+先析出沉淀;依据Ksp(FeAsO4 )=c(Fe3+)c(AsO43-)=5.7×10-21;Fe3+的浓度均为1.0×10-4mol?L-1,则 c(AsO43-)=
| Ksp(FeAsO4) |
| c(Fe3+) |
(3)三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),则该反应的离子方程式为:2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O;
故答案为:2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O;
(4)①硫酸钙难溶于酸,所以酸性条件下能析出,因此pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为CaSO4,故答案为:CaSO4;
②H3AsO4是弱酸电离出来的AsO43-较少,所以酸性条件下不易形成Ca3(AsO4)2沉淀,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀,
故答案为:H3AsO4是弱酸,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀;
③H3AsO4的第三步电离式为HAsO42-?H++AsO43-,所以第三步电离的平衡常数的表达式为K3=
| c(AsO43-)?c(H+) |
| c(HAsO42-) |
| c(HAsO42-)?c(OH-) |
| c(AsO43-) |
| c(HAsO42-)?c(OH-)?c(H+) |
| c(AsO43-)?c(H+) |
| Kw |
| K3 |
| 10-14 |
| 4.0×10-12 |
故答案为:2.5×10-3.

 习题精选系列答案
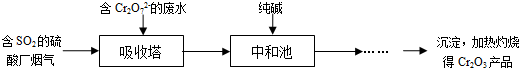
习题精选系列答案某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,工艺流程如下:

相关数据如下表,请回答以下问题:
表1.几种盐的Ksp
|
难溶物 |
Ksp |
|
Ca3(AsO4)2 |
6.8×10-19 |
|
CaSO4 |
9.1×10-6 |
|
FeAsO4 |
5.7×10-21 |
表2.工厂污染物排放浓度及允许排放标准
|
污染物 |
H2SO4 |
As |
|
废水浓度 |
29.4g/L |
1.6g·L-1 |
|
排放标准 |
pH 6~9 |
0.5mg·L-1 |
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)= mol·L-1。
(2)若酸性废水中Fe3+的浓度为1.0×10-4mol·L-1,c(AsO43-)= mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀,原因为
。
③砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3 K2=1.7×10-7 K3=4.0×10-12,第三步电离的平衡常数的表达式为K3=
。Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O HAsO42-+OH-,该步水解的平衡常数(25℃)为:
(保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为:
(保留两位有效数字)。