题目内容
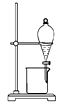
【题目】某化学兴趣小组用如图装置电解CuSO4溶液,测定铜的相对原子质量. 
(1)若实验中测定在标准状况下放出的氧气的体积VL,B连接直流电源的(填“正极”或“负极”),并写出B极发生反应的电极反应式 .
(2)电解开始一段时间后,在U形管中可观察到的现象 .
并写出该电解反应总的离子方程式 .
(3)实验中还需测定的数据是(填写序号).
①A极的质量增重mg ②B极的质量增重mg
(4)铜的相对原子质量为:(用含有m、V的计算式表示).
(5)如果用碱性(KOH为电解质)甲烷燃料电池作为电源进行实验,放电时负极的电极反应式为 .
【答案】
(1)正极;4OH﹣﹣4e﹣=O2↑+2H2O
(2)铜电极上有红色固体析出,石墨电极上有无色气体产生,溶液蓝色变浅;2Cu2++2H2O ![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
(3)①
(4)![]()
(5)CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O
【解析】解:(1)若实验中测定在标准状况下放出的氧气的体积VL,说明阳极上是氢氧根离子放电而不是铜放电,所以铜作阴极,石墨作阳极,则A连接直流电源的负极,B连的是正极,是阳极,发生反应:4OH﹣﹣4e﹣=O2↑+2H2O,所以答案是:正极;4OH﹣﹣4e﹣=O2↑+2H2O;(2)电解硫酸铜时,石墨作阳极,则阴极上铜离子得电子而析出铜,阳极上氢氧根离子放电而生成氧气,溶液中铜离子浓度减小,溶液颜色变浅,电池反应式为:2Cu2++2H2O ![]() 2Cu+O2↑+4H+ , 所以答案是:铜电极上有红色固体析出,石墨电极上有无色气体产生,溶液蓝色变浅;2Cu2++2H2O
2Cu+O2↑+4H+ , 所以答案是:铜电极上有红色固体析出,石墨电极上有无色气体产生,溶液蓝色变浅;2Cu2++2H2O ![]() 2Cu+O2↑+4H+;(3)要测定铜的相对原子质量还要测定析出铜的质量,A电极上析出铜,故选①;(4)根据2Cu2++2H2O
2Cu+O2↑+4H+;(3)要测定铜的相对原子质量还要测定析出铜的质量,A电极上析出铜,故选①;(4)根据2Cu2++2H2O ![]() 2Cu+O2↑+4H+知,标况下,生成22.4L氧气析出2mol铜,析出mg铜时放出VL氧气,则铜的相对原子质量=
2Cu+O2↑+4H+知,标况下,生成22.4L氧气析出2mol铜,析出mg铜时放出VL氧气,则铜的相对原子质量= ![]() =
= ![]() ,所以答案是:
,所以答案是: ![]() ;(5)甲烷燃料电池中,负极上甲烷失电子发生氧化反应,电极反应式为:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O,所以答案是:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O.
;(5)甲烷燃料电池中,负极上甲烷失电子发生氧化反应,电极反应式为:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O,所以答案是:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O.

【题目】某小组同学以碳棒为电极电解CuCl2溶液时,发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出.为探究阴极碳棒上的产物,同学们阅读资料并设计了如下过程:
Ⅰ.有关资料:铜的化合物颜色性质如下
物质 | 颜色、性质 | 物质 | 颜色、性质 |
氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 |
氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 浓溶液呈绿色,稀溶液呈蓝色 |
氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
Ⅱ.探究实验:
(1)提出假设:
①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为 .
(2)实验验证:
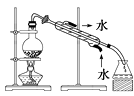
取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,连接下列装置进行实验,验证阴极产物,
①实验前,检查装置A气密性的方法是 .
②实验时,各装置从左至右的连接顺序为A→→→B→→
(3)观察现象,得出结论
实验结束后,碳棒上的白色物质变为红色,F中物质不变色,D中出现白色沉淀,根据现象①碳棒上的红色物质是否有Cu2O(填“是”或“否”),理由是;
②装置(填上图中装置编号)中的现象说明提出假设②中的白色物质一定存在;
③写出装置B中发生反应的化学方程式 .