题目内容
对于平衡体系:aA(g)+bB(g) cC(g)+dD(g);正反应放热,有下列判断,其中正确的是( )
cC(g)+dD(g);正反应放热,有下列判断,其中正确的是( )
A.若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.45倍,则 a+b>c+d
B.若从正反应开始,平衡时,A、B的转化率相等,则投入A、B的物质的量之比为a:b
C.若平衡体系中共有气体M mol,再向其中充入6 mol B,达到平衡时 气体总物质的量为(M+b)mol,则a+b>c+d
D. a+b=c+d,则当容器温度上升时,平衡向左移动,容器中气体的压强不变
练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
某化学兴趣小组在课外活动中,对某溶液进行了多次检测,其中的三次检测结果如下表所示,请回答:
检测次数 | 溶液中检测出的溶质 |
第一次 | KCl、K2SO4、Na2CO3、NaCl |
第二次 | KCl、BaCl2、Na2CO3、K2CO3 |
第三次 | Na2CO3、KCl、K2SO4、NaCl |
(1)三次检测结果中第___________次的检测结果肯定不正确。
(2)在检测时,为了确定溶液中是否存在SO 、CO
、CO 和Cl-,该小组同学进行了如下实验,请你参与探究与分析,完成表格。
和Cl-,该小组同学进行了如下实验,请你参与探究与分析,完成表格。



 工、石油精炼、粗盐精制、玻璃制造等领域。工业上以食盐、氨气(主要由合成氨厂提供)和二氧化碳为主要原料生产纯碱。其流程如下:
工、石油精炼、粗盐精制、玻璃制造等领域。工业上以食盐、氨气(主要由合成氨厂提供)和二氧化碳为主要原料生产纯碱。其流程如下:
 )
)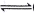 CH3OH(g)。
CH3OH(g)。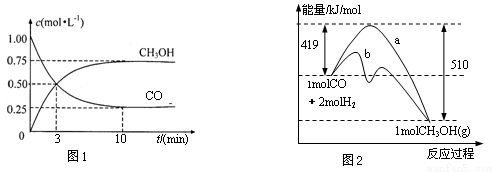
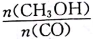 增大的措施有____________。
增大的措施有____________。 l3+全部沉淀出来可使用氨水
l3+全部沉淀出来可使用氨水 3C(g)+D(s),10min后达到平衡,平衡时C的速率为0.12 mol/(L。min)。
3C(g)+D(s),10min后达到平衡,平衡时C的速率为0.12 mol/(L。min)。 持容器的温度不变,若缩小容器的体积,则平衡____________移动(填“
持容器的温度不变,若缩小容器的体积,则平衡____________移动(填“ 向正反应方向”或“向逆反应方向”或“不”)。
向正反应方向”或“向逆反应方向”或“不”)。 是____________。
是____________。