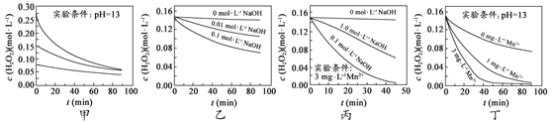
题目内容
【题目】纯的叠氮酸(HN3)是一种弱酸,常温下向25mL0.1mol/LNaOH溶液中加入0.2mol/LHN3溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如图。下列说法不正确的是( )
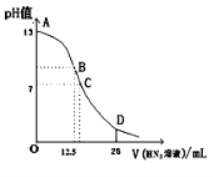
A.该滴定过程中应用酚酞作指示剂
B.若B点pH=8,则c(HN3)=(10-6-10-8)mol/L
C.沿曲线A→B→C的过程中,由水电离产生的c(OH-)逐渐减少
D.点D对应溶液中存在关系:c(N![]() )>c(Na+)>c(HN3)
)>c(Na+)>c(HN3)
【答案】C
【解析】
A.NaOH与HN3等物质的量反应后溶液显碱性,滴定时选择在碱性条件下变色的指示剂,可选择酚酞作指示剂,故A正确;
B.B点pH=8,c(H+)=10-8mol/L,c(OH-)=10-6mol/L,B点NaOH与HN3恰好反应生成NaN3,根据质子守恒可得:c(OH-)=c(HN3)+c(H+),则c(HN3)=c(OH-)-c(H+)=(10-6-10-8)mol/L,故B正确;
C.因为A点时,NaOH存在,抑制水的电离,C点时HN3过量,也抑制水的电离,只有B点恰好完全反应,只存在盐类的水解,促进水的电离,所以B点水的电离程度最大,B点后水的电离程度逐渐减小,则曲线A→B→C的过程中,由水电离产生的c(OH-)先增大后减少,故C错误;
D.D点时,加入的HN3的物质的量是NaOH的2倍,溶液呈酸性,则c(OH-)<c(H+),根据电荷守恒c(H+)+c(Na+)=c(N3-)+c(OH-)可知:c(N3-)>c(Na+),结合物料守恒2c(Na+)=c(HN3)+c(N3-)可得:c(N3-)>c(Na+)>c(HN3),故D正确;
答案为C。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】已知A(g)+B(g) ![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的 ΔH________0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B, 反应经一段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol氩气,再次达平衡时A的转化率 ________(填“增大”、“减小”或“不变”);
(3)下列选项可作为判断该反应达到平衡的依据是______:
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(4)1200 ℃时反应C(g)+D(g) ![]() A(g)+B(g)的平衡常数的值为________。
A(g)+B(g)的平衡常数的值为________。