题目内容
【题目】煤燃烧排放的烟气含有SO2和NOx(主要成分为NO、NO2的混合物),对烟气进行脱硫、脱硝有多种方法。
(1)碱液吸收法:采用石灰乳脱除SO2.脱除后的主要产物是_____。
(2)液相氧化法:采用 NaClO溶液进行脱除。
①NaClO水解的离子方程式是_____。
②NaClO溶液吸收NO的主要过程如下
i.NO(aq)+HClO(aq)NO2(aq)+HCl(aq) △H1
ii.3NO2(aq)+H2O(1)2HNO3(aq)+NO(aq) △H2
NO(aq)转化为HNO3(aq)的热化学方程式是_____。
③研究pH对NO脱除率的影响。调节 NaClO溶液的初始pH,NO的脱除率如表:
初始pH | 3.5 | 4.5 | 5.5 | 6.5 | 7.5 |
NO脱除率 | 91% | 88% | 83% | 65% | 51% |
pH影响NO脱除率的原因是_____。
(3)研究发现,在液相氧化法中,一定量的SO2能提高NOx的脱除率。当pH=5.5时,SO2对有效氯含量、NOx脱除率的影响如图所示。
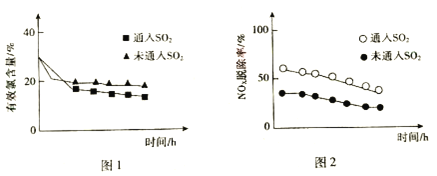
①据图1,通入SO2后有效氯含量降低。SO2和HClO反应的离子方程式是_____。
②针对图2中NOx脱除率提高的原因,研究者提出了几种可能发生的反应:
A.SO2+2NO+H2O═N2O+H2SO4
B.2SO2+2NO+2H2O═N2+2H2SO4
C.4SO2+2NO2+4H2O═N2+4H2SO4
用同位素示踪法确认发生的反应:把15NO2和NO按一定比例混合,通入SO2的水溶液中,检测气体产物。
a.气体产物中主要含有15NO2、N2O,则发生的主要反应是_____(填序号)。
b.同时检测到气体产物中还有15N N,产生15N N的化学方程式是_____。
【答案】CaSO3 ClO﹣+H2OHClO+OH﹣ 2NO(aq)+3HClO(aq)=2HNO3(aq)+3HCl(aq)△H=3△H1+△H2 pH越小,NaClO的水解平衡右移,即水解程度越大,溶液中HClO的浓度越高,则反应i的平衡右移,则NO脱除率越高 SO2+HClO+H2O=3H++![]() +Cl- A 15NO2+NO+3SO2+3H2O=15N N+3H2SO4
+Cl- A 15NO2+NO+3SO2+3H2O=15N N+3H2SO4
【解析】
(1)SO2是酸性氧化物,能和碱反应生成盐和水;
(2)①NaClO是强碱弱酸盐,ClO﹣水解显碱性;
②根据盖斯定律,将反应i和反应ii做相应的变形得到目标反应,反应热做相应的变化即可;
③pH越小则NaClO的水解程度越大,即溶液中HClO的浓度越高,根据平衡移动的方向来分析;
(3)①SO2和HClO反应时,SO2被氧化为H2SO4,HClO被还原为HCl,据此写出离子方程式;
②a.气体产物中主要含有15NO2、N2O,则说明15NO2没有被消耗,只有NO被消耗生成了N2O,据此分析;
b.同时检测到气体产物中还有15N N,则说明15NO2和NO均参与了反应,且参与此反应的两者的物质的量之比为1:1,两者均被还原,而SO2被氧化为H2SO4,据此写出化学方程式。
(1)SO2是酸性氧化物,能和碱反应生成盐和水,故二氧化硫被石灰乳即Ca(OH)2吸收后生成的是CaSO3和水,故答案为:CaSO3;
(2)①NaClO是强碱弱酸盐,ClO﹣水解显碱性:ClO﹣+H2OHClO+OH﹣,故答案为:ClO﹣+H2OHClO+OH﹣;
②根据盖斯定律,i×3+ii即可得目标反应:2NO(aq)+3HClO(aq)=2HNO3(aq)+3HCl(aq),则反应热△H=3△H1+△H2,故答案为:2NO(aq)+3HClO(aq)=2HNO3(aq)+3HCl(aq)△H=3△H1+△H2;
③NaClO是强碱弱酸盐,溶液中存在水解平衡,溶液显碱性,pH越小,酸性越强,促进了NaClO的水解平衡向右移动,即水解程度越大,溶液中HClO的浓度越高,则反应i的平衡右移,则NO脱除率越高,故答案为:pH越小,NaClO的水解平衡右移,即水解程度越大,溶液中HClO的浓度越高,则反应i的平衡右移,则NO脱除率越高;
(3)①SO2和HClO反应时,SO2被氧化为H2SO4,HClO被还原为HCl,根据得失电子守恒和电荷守恒可知离子方程式为SO2+HClO+H2O=3H++![]() +Cl﹣,故答案为:SO2+HClO+H2O=3H++
+Cl﹣,故答案为:SO2+HClO+H2O=3H++![]() +Cl﹣;
+Cl﹣;
②a.气体产物中主要含有15NO2、N2O,则说明15NO2没有被消耗,只有NO被消耗生成了N2O,则说明发生了反应A,故答案为:A;
b.同时检测到气体产物中还有15N N,则说明15NO2和NO均参与了反应,且参与此反应的两者的物质的量之比为1:1,两者均被还原为0价,而SO2被氧化为H2SO4,据此得失电子守恒可知化学方程式为:15NO2+NO+3SO2+3H2O=15N N+3H2SO4.故答案为:15NO2+NO+3SO2+3H2O=15N N+3H2SO4。

【题目】碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1=+489.0kJ/mol
C(石墨)+CO2(g)=2CO(g) △H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为____;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为_;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:_____;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是_____(填序号)
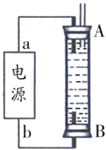
A.电源中的a一定为正极,b一定为负极 B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极 D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
H2O | CO | CO2 | |||
1 | 650 | 2 | 4 | 1.6 | 5 |
2 | 900 | 1 | 2 | 0.4 | 3 |
3 | 900 | 1 | 2 | 0.4 | 1 |
①该反应的正反应为_____(填“吸”或“放”)热反应;
②实验2中,平衡常数K=_____;
③实验3跟实验2相比,改变的条件可能是_____(答一种情况即可);
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序_____.
【题目】工业上用粗CuO粉末(含有Fe2O3和FeO杂质)制备纯净的CuCl2·xH2O晶体。
有关金属离子开始沉淀和沉淀完全时溶液的pH
离子 | Cu2+ | Fe2+ | Fe3+ |
开始沉淀pH | 5.4 | 8.1 | 2.7 |
沉淀完全pH | 6.9 | 9.6 | 3.7 |
制备方法如下:
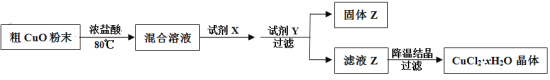
(1)加入试剂X的目的是将Fe2+氧化为Fe3+,试剂X是_______。
(2)加入试剂Y的目的是调节溶液的pH,试剂Y是______,调节pH的范围是_____,生成的固体Z是________。