题目内容
4.A和B是两种有气味的气体,它们在空气中都不能被点燃,A的相对分子质量比B大,在B溶液中通入A气体,溶液的酸性显著增强,在溶液中滴加Ba(NO3)2溶液,生成一种不溶于硝酸的白色沉淀,沉淀完全过滤后,再在滤液中滴加AgNO3溶液,也生成一种不溶于硝酸的白色沉淀.由上述现象判断A气体是Cl2,B气体是SO2,B溶液中通入A气体发生反应的离子方程式为SO2+Cl2+2H2O═4H++2Cl-+SO42-.分析 A和B是两种有气味的气体,它们在空气中都不能被点燃,在B溶液中通入A气体,溶液的酸性显著增强,说明二者混合后发生了反应;在溶液中滴加Ba(NO3)2溶液,生成一种不溶于硝酸的白色沉淀,该沉淀为硫酸钡,则有一种气体为SO2;沉淀完全过滤后,再在滤液中滴加AgNO3溶液,也生成一种不溶于硝酸的白色沉淀,该沉淀为AgCl,说明另一种气体为Cl2,由于A的相对分子质量比B大,则A为氯气,B为二氧化硫,据此进行解答.
解答 解:A和B是两种有气味的气体,它们在空气中都不能被点燃,在B溶液中通入A气体,溶液的酸性显著增强,说明二者混合后发生了反应;在溶液中滴加Ba(NO3)2溶液,生成一种不溶于硝酸的白色沉淀,该沉淀为硫酸钡,则有一种气体为SO2;沉淀完全过滤后,再在滤液中滴加AgNO3溶液,也生成一种不溶于硝酸的白色沉淀,该沉淀为AgCl,说明另一种气体为Cl2,由于A的相对分子质量比B大,则A为Cl2,B为SO2,氯气与二氧化硫在溶液中发生氧化还原反应生成硫酸和氯化氢,反应的离子方程式为:SO2+Cl2+2H2O═4H++2Cl-+SO42-,
故答案为:Cl2;SO2;SO2+Cl2+2H2O═4H++2Cl-+SO42-.
点评 本题考查了无机推断,题目难度中等,明确硫酸根离子、氯离子的性质及检验方法为解答关键,注意掌握二氧化硫、氯气的化学性质,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
3.有机物M的结构简式为: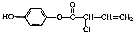 ,有关M下列叙述中正确的是( )
,有关M下列叙述中正确的是( )
 ,有关M下列叙述中正确的是( )
,有关M下列叙述中正确的是( )| A. | 可与H2反应,1mol M最多消耗5mol H2 | |
| B. | 可与浓溴水反应,1mol M最多消耗4mol Br2 | |
| C. | 可与NaOH溶液反应,1mol M最多消耗4mol NaOH | |
| D. | 常温下,M在水中的溶解度大于苯酚在水中的溶解度 |
16.合乎实际并用于工业生产的是( )
| A. | 金属钠在氯气中燃烧制氯化钠 | B. | 氢气和氯气混合经光照制氯化氢 | ||
| C. | 氯气通入氢氧化钙溶液中制漂白粉 | D. | 煅烧石灰石制生石灰 |
13.等质量的乙烯和聚乙烯完全燃烧消耗氧气的物质的量的关系是( )
| A. | 前者大 | B. | 后者大 | C. | 相等 | D. | 不能确定 |

 .
.