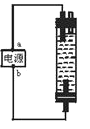
题目内容
【题目】X、Y、Z三种常见的短周期元素,可形成XY2、Z2Y、XY3、Z2Y2、Z2X等化合物,已知Y的离子和Z的离子具有相同的电子层结构,X离子比Y离子多一个电子层,试回答:
(1)X、Y、Z的单质的晶体分别属于_______晶体,________晶体,_____晶体
(2)Z2Y2的电子式为___________,Z2Y2溶于水的化学方程式为__________。
(3)XY3在标准状态下是针状晶体,它属于___________晶体,XY3的水溶液与Z2Y2反应可生成一种具有漂白性的氧化剂H2Y2,其化学方程式为_______。
【答案】分子 分子 金属 ![]() 2Na2O2+2H2O=4NaOH+O2↑ 分子 H2SO4+ Na2O2= Na2SO4+ H2O2
2Na2O2+2H2O=4NaOH+O2↑ 分子 H2SO4+ Na2O2= Na2SO4+ H2O2
【解析】
由Z2Y、Z2Y2可推测是H2O、H2O2或Na2O、Na2O2,又因为Y离子和Z离子具有相同的电子层结构,所以只能是Na2O、Na2O2,由此知Z为Na,Y为O,由于XY2、XY3,可知X可形成+4、+6价的化合物,且X离子比Y离子多1个电子层,X只能是S,结合对应物质的性质以及题目要求解答该题。
由Z2Y、Z2Y2可推测是H2O、H2O2或Na2O、Na2O2,又因为Y离子和Z离子具有相同的电子层结构,所以只能是Na2O、Na2O2,由此知Z为Na,Y为O,由于XY2、XY3,可知X可形成+4、+6价的化合物,且X离子比Y离子多1个电子层,X只能是S;
(1)X、Y、Z的单质分别为S、O2、Na;分别属于分子晶体,分子晶体,金属晶体;
(2)Z2Y2为Na2O2,其电子式为![]() ,Na2O2溶于水反应生成氢氧化钠和氧气,反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;
,Na2O2溶于水反应生成氢氧化钠和氧气,反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;
(3)XY3为SO3,在标准状态下是针状晶体,它属于分子晶体,XY3的水溶液与Z2Y2反应可生成一种具有漂白性的氧化剂H2Y2,其化学方程式为H2SO4+ Na2O2= Na2SO4+ H2O2。

 阅读快车系列答案
阅读快车系列答案【题目】下列各组物质中,不能按![]() (“→”表示一步完成)的关系相互转化的是 ( )
(“→”表示一步完成)的关系相互转化的是 ( )
选项 | a | b | c |
A | Fe | FeCl3 | FeCl2 |
B | Cl2 | NaClO | NaCl |
C | Si | SiO2 | H2SiO3 |
D | HNO3 | NO | NO2 |
A.AB.BC.CD.D