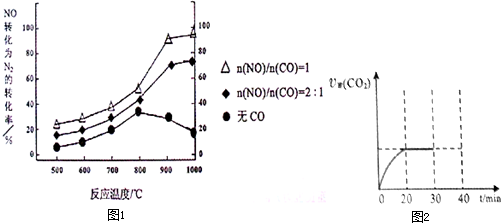
题目内容
(1)已知:向NaNH2的液氨溶液中加入NH4Cl,发生反应NaNH2+NH4Cl====NaCl+2NH3,该反应的离子方程式为___________,该反应属于___________ (填写编号)。A.化合反应 B.复分解反应
C.氧化还原反应 D.置换反应
(2)离子型叠氮化物可以制成轿车的“安全气囊”,叠氮离子(![]() )可由氨基钠(NaNH2)与
)可由氨基钠(NaNH2)与![]() 在一定条件下合成,完成并配平反应的离子方程式:
在一定条件下合成,完成并配平反应的离子方程式:
□![]() +□
+□![]() ====□
====□![]() +□NH3↑+□□
+□NH3↑+□□
(3)叠氮酸(HN3)分子中共用电子对和未成键电子对的数目分别为6和2,据此写出叠氮酸分子可能的结构式_____________。
解析:(1)根据相似相溶原理可知,NaNH2、NH4Cl和NaCl皆易溶于液氨且完全电离,故反应的离子方程式为:![]() +
+![]() ====2NH3,反应中各元素的价态都没有变化,无单质参加或生成,且产物有两种,该反应只能为复分解反应。(2)用化合价升降法配平。在该反应中还原剂
====2NH3,反应中各元素的价态都没有变化,无单质参加或生成,且产物有两种,该反应只能为复分解反应。(2)用化合价升降法配平。在该反应中还原剂![]()
![]()
![]() ,化合价升高总数为-
,化合价升高总数为-![]() -(-3)=
-(-3)=![]() ;氧化剂
;氧化剂![]()
![]()
![]() ,化合价降低总数为5-(-
,化合价降低总数为5-(-![]() )=
)=![]() ,由此可确定氧化剂与还原产物,还原剂与氧化产物的化学计量数,再根据电荷守恒确定所缺物质,最后观察配平。
,由此可确定氧化剂与还原产物,还原剂与氧化产物的化学计量数,再根据电荷守恒确定所缺物质,最后观察配平。
(3)氢原子与氮原子间可形成一个共用电子对,相邻的两个氮原子间,一者形成2个电子对,另一者则形成3个共用电子对,由此便可确定其结构式。
答案:(1)![]() +
+![]() ====2NH3 B
====2NH3 B
(2)![]() +
+![]() ====
====![]() +NH3↑+3 OH-
+NH3↑+3 OH-
(3)H—N=N≡N

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
H2和I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-a kJ?mol-1
已知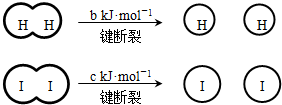 (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
已知
 (a、b、c均大于零)
(a、b、c均大于零)下列说法不正确的是( )
| A、反应物的总能量高于生成物的总能量 | B、断开1mol H-H键和1mol I-I键所需能量大于断开2mol H-I键所需能量 | C、断开2mol H-I键所需能量约为(c+b+a)kJ | D、向密闭容器中加入2mol H2和2mol I2,充分反应后放出的热量小于2a kJ |