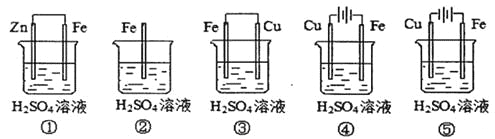
ĖâÄŋÄÚČÝ
ĄūĖâÄŋĄŋĘŌÎÂÏÂĢŽ―ŦÄōËáÄÆ(NaUr)ÐüŨĮŌšūēÖÃĢŽČĄÉÏēãĮåŌšĢŽÔŲÍĻČëHClĢŽČÜŌšÖÐÄōËáĩÄÅĻķČc(NaUr)ÓëpHĩÄđØÏĩČįÍžËųĘūĄĢŌŅÖŠĢšKsp(NaUr)=4.9ĄÁ10-5ĢŽKa(HUr)=2.0ĄÁ10-6ĄĢÏÂÁÐËĩ·ĻÕýČ·ĩÄĘĮ![]()
![]()
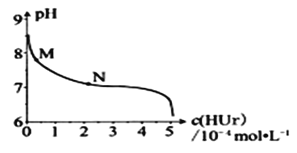
A.ÉÏēãĮåŌšÖÐĢŽc(Ur-)=7.0ĄÁ10-2molL-1
B.ÔÚMĄúNĩÄąäŧŊđýģĖÖÐĢŽc(Na+)c(Ur-)ĩÄÖĩąĢģÖēŧąä
C.ĩąc(NaUr)= c(Ur-)ĘąĢŽc(Cl-)>c(Ur-)
D.ĩąpH=7ĘąĢŽ2c(Na+)=c(Ur-)+c(Cl-)
Ąūīð°ļĄŋC
Ąū―âÎöĄŋ
A.ļųūÝKsp(NaUr)= c(Na+)c(Ur-)=4.9ĄÁ10-5ĢŽĮóģöc(Ur-)Ģŧ
B.ÔÚMĄúNĩÄąäŧŊđýģĖÖÐĢŽÍĻČëÂČŧŊĮâĢŽc(Na+)ēŧąäĢŽc(Ur-)žõÐĄĢŧ
C.ļųūÝĩįšÉĘØšãšÍÎïÁÏĘØšã―øÐзÖÎöÅÐķÏĢŧ
D.ĩąpH=7ĘąĢŽČÜŌšģĘÖÐÐÔĢŽļųūÝĩįšÉĘØšã―øÐзÖÎöÅÐķÏĄĢ
A.ļųūÝKsp(NaUr)= c(Na+)c(Ur-)=4.9ĄÁ10-5ĢŽĮóģöc(Ur-)=![]() =7.0ĄÁ10-3mol/LĢŽAÏîīíÎóĢŧ
=7.0ĄÁ10-3mol/LĢŽAÏîīíÎóĢŧ
B.ÔÚMĄúNĩÄąäŧŊđýģĖÖÐĢŽÍĻČëÂČŧŊĮâĢŽc(Na+)ēŧąäĢŽc(Ur-)žõÐĄĢŽđĘc(Na+)c(Ur-)ĩÄÖĩžõÐĄĢŽBÏîīíÎóĢŧ
C.ļųūÝĩįšÉĘØšãÓÐĢšc(Na+)+c(H+)=c(Cl-)+c(Ur-)+c(OH-)ĢŽļųūÝÎïÁÏĘØšãÓÐĢšc(Na+)= c(Ur-)+c(HUr)ÖŠc(HUr)+c(H+)=c(Cl-)+c(OH-)ĢŽČôc(Ur-)=c(HUr)ÔōÂúŨãc(Ur-)+c(H+)=c(Cl-)+c(OH-)ĢŽĩąc(Ur-)=c(HUr)ĘąĢŽļųūÝKa(HUr)=2.0ĄÁ10-6ĩÃc(H+)=2.0ĄÁ10-6mol/L>c(OH-)=![]() ĢŽŌōīËc(Cl-)>c(Ur-)ĢŽCÏîÕýČ·Ģŧ
ĢŽŌōīËc(Cl-)>c(Ur-)ĢŽCÏîÕýČ·Ģŧ
D.ĩąpH=7ĘąĢŽČÜŌšģĘÖÐÐÔĢŽļųūÝĩįšÉĘØšãĩÃc(Na+)=c(Ur-)+c(Cl-)ĢŽDÏîīíÎóĢŧ
īð°ļŅĄCĄĢ

ĄūĖâÄŋĄŋXĄĒYĄĒZĄĒWĄĒQĄĒRÁųÖÖķĖÖÜÆÚÖũŨåÔŠËØĢŽÔŨÓÐōĘýŌĀīÎÔöīóĢŽZŧųĖŽÔŨÓšËÍâÓÐČýļöÎīģÉķÔĩįŨÓĢŽYĄĒZĄĒW·ÖąðÓëXÐÎģÉģĢžûŧŊšÏÎïĩÄ·ÖŨÓ―áđđŌĀīÎΊÕýËÄÃæĖåÐÎĄĒČý―ĮŨķÐΚÍVÐÎĢŽQĩÄļũžķĩįĀëÄÜČįÏÂąíĢŽWÓëRĘĮÍŽŨåÔŠËØĄĢ
Q | I1 | I2 | I3 | I4 | I5 | Ą |
ĩįĀëÄÜĢĻkJ/molĢĐ | 496 | 4562 | 6912 | 9543 | 13353 | Ą |
ŧØīðÏÂÁÐÓÐđØÎĘĖâĢš
ĢĻ1ĢĐWÔŨÓĩÄÍâΧĩįŨÓÅÅēžÍžÎŠ____________ĄĢ
ĢĻ2ĢĐŧŊšÏÎïXYZĩÄ―áđđĘ―ĘĮ______ĄĢ
ĢĻ3ĢĐÏāÍŽĖõžþÏÂĢŽYW2ĄĒRW2Á―ÕßÔÚËŪÖÐĩÄČÜ―âķČ―ÏīóĩÄĘĮ__________ĢĻÐī·ÖŨÓĘ―ĢĐĢŽÔŌōĘĮ_________ĄĢ
ĢĻ4ĢĐRW3·ÖŨÓÖÐĩÄžü―Į_______ĢŽRW32-ĩÄÁĒĖåđđÐÍĘĮ_________ÐÎĄĢ
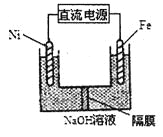
ĄūĖâÄŋĄŋÆûģĩÎēÆøÖКŽÓÐCOĄĒNOĩČÓКĶÆøĖåĄĢ
ĢĻ1ĢĐÆûģĩÎēÆøÖÐNOÉúģÉđýģĖĩÄÄÜÁŋąäŧŊČįÍžĘūĄĢ1molN2šÍ1molO2ÍęČŦ·īÓĶÉúģÉNOŧá____ĢĻĖÎüĘÕĄąŧōĄ°·ÅģöĄąĢĐ____kJÄÜÁŋĄĢ

ĢĻ2ĢĐÍĻđýNOīŦļÐÆũŋÉžāēâÆûģĩÎēÆøÖÐNOĩÄšŽÁŋĢŽÆäđĪŨũÔĀíČįÍžËųĘūĢšĢĻĖáĘūĢšO2-ŋÉÔÚīËđĖĖåĩį―âÖĘÖÐŨÔÓÉŌÆķŊĢĐ

ĒŲNiOĩįžŦÉÏ·ĒÉúĩÄĘĮ___________·īÓĶĢĻĖŅõŧŊĄąŧōĄ°ŧđÔĄąĢĐĄĢ
ĒÚÍâĩį·ÖÐĢŽĩįŨÓĘĮīÓ_________ĩįžŦÁũģöĢĻĖNiOĄąŧōĄ°PtĄąĢĐĢŪ
ĒÛPtĩįžŦÉÏĩÄĩįžŦ·īÓĶĘ―ÎŠ________________________ĄĢ
ĢĻ3ĢĐŌŧÖÖÐÂÐÍīßŧŊžÁÓÃÓÚNOšÍCOĩÄ·īÓĶĢš2NO+2CO![]() 2CO2+N2ĄĢŌŅÖŠÔöīóīßŧŊžÁĩĹȹíÃæŧýŋÉĖáļßļ÷īÓĶËŲÂĘĢŽÎŠÁËŅéÖĪÎÂķČĄĒīßŧŊžÁĩĹȹíÃæŧýķÔŧŊŅ§·īÓĶËŲÂĘĩÄÓ°ÏėđæÂÉĢŽÄģÍŽŅ§ÉčžÆÁËČýŨéĘĩŅéĢŽēŋ·ÖĖõžþŌŅūĖîÔÚÏÂąíÖÐĄĢ
2CO2+N2ĄĢŌŅÖŠÔöīóīßŧŊžÁĩĹȹíÃæŧýŋÉĖáļßļ÷īÓĶËŲÂĘĢŽÎŠÁËŅéÖĪÎÂķČĄĒīßŧŊžÁĩĹȹíÃæŧýķÔŧŊŅ§·īÓĶËŲÂĘĩÄÓ°ÏėđæÂÉĢŽÄģÍŽŅ§ÉčžÆÁËČýŨéĘĩŅéĢŽēŋ·ÖĖõžþŌŅūĖîÔÚÏÂąíÖÐĄĢ
ĘĩŅéąāšÅ | tĢĻĄæĢĐ | NOģõĘžÅĻķČ ĢĻmol/LĢĐ | COģõĘžÅĻķČĢĻmol/LĢĐ | īßŧŊžÁĩĹȹíÃæŧýĢĻm2/gĢĐ |
Ēņ | 280 | 1.2ĄÁ10Đ3 | 5.80ĄÁ10Đ3 | 82 |
Ēō | 280 | 1.2ĄÁ10Đ3 | b | 124 |
Ēó | 350 | a | 5.80ĄÁ10Đ3 | 82 |
ĒŲĮë―ŦąíÖÐĘýūÝēđģäÍęÕûĢša ___________ĄĢ
ĒÚÄÜŅéÖĪÎÂķČķÔŧŊŅ§·īÓĶËŲÂĘđæÂÉĩÄĘĮĘĩŅé____________ĢĻĖîĘĩŅéÐōšÅĢĐĄĢ
ĒÛĘĩŅéĒņšÍĘĩŅéĒōÖÐĢŽNOĩÄÎïÖĘĩÄÁŋÅĻķČcĢĻNOĢĐËæĘąžätĩÄąäŧŊĮúÏßČįÍžËųĘūĢŽÆäÖÐąíĘūĘĩŅéĒōĩÄĘĮĮúÏß_______ĢĻĖžŨĄąŧōĄ°ŌŌĄąĢĐĄĢ

ĢĻ4ĢĐÔÚČÝŧýđĖķĻĩÄūøČČČÝÆũÖзĒÉú·īÓĶ2NO+2CO2CO2+N2ĢŽēŧÄÜËĩÃũŌŅīïĩ―Æ―šâŨīĖŽĩÄĘĮ________ĢĻēŧķĻÏîŅĄÔņĢĐĢŧ
AĢŪČÝÆũÄÚŧėšÏÆøĖåÎÂķČēŧÔŲąäŧŊ BĢŪČÝÆũÄÚĩÄÆøĖåŅđĮŋąĢģÖēŧąä
CĢŪ2ĶÔÄæ(NO)=ĶÔÕý(N2) DĢŪČÝÆũÄÚŧėšÏÆøĖåÃÜķČąĢģÖēŧąä