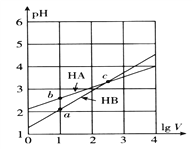
题目内容
【题目】硫及硫化物广泛存在于自然界中,回答下列问题:
(1)基态S原子中,核外电子占据的最高能层的符号是___________,有__________种不同形状的电子云。
(2)(NH4)2SO4中O、N、S三种元素的第一电离能的大小关系为_______________________。
(3)中学化学常用KSCN检验Fe3+,列举一种与SCN-互为等电子体的分子:___________,SCN-中C原子的杂化方式为_________________。
(4)乙硫醇(CH3CH2SH)的相对分子质量比CH3CH2OH大,但乙醇的沸点高于乙硫醇的原因是_________________________________________________。
(5)PbS是一种重要的半导体材料,具有NaC1型结构(如图),其中阴离子采用面心立方最密堆积方式,X-射线衍射实验测得PbS的晶胞参数为a=0.594 n m。
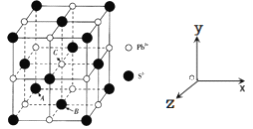
①已知坐标参数:A(0,0,0),B![]() ,则C的坐标参数为__________________。
,则C的坐标参数为__________________。
②PbS晶体中Pb2+的配位数为_________,r(S2-)为______nm。(已知![]() )
)
③PbS晶体的密度为_________g·cm-3。(列出计算式即可)
【答案】 M 2 N>O>S CO2、CS2、N2O、COS等 sp 乙醇分子间存在氢键 (![]() ,
,![]() ,
,![]() ) 6 0.210
) 6 0.210 ![]()
【解析】(1)S为16号元素,基态S原子核外有3个电子层,核外电子占据的最高能层的符号是M,核外有s、p2种不同形状的电子云,故答案为:M;2;
(2) 同周期,第一电离能总体呈现从左至右逐渐增大的变化趋势;同主族,从上至下第一电离能逐渐减小。但N的2p为半充满结构,均为稳定,因此O、N、S三种元素的第一电离能的大小关系为N>O>S,故答案为:N>O>S;
(3)与SCN-互为等电子体的分子有CO2、CS2、N2O等,SCN-的结构与二氧化碳相似,C原子的杂化方式与二氧化碳中的C原子的杂化方式相同,为sp杂化,故答案为:CO2、CS2、N2O、COS等;sp;
(4) 乙醇分子间存在氢键,而乙硫醇(CH3CH2SH) 分子间不存在氢键,导致乙醇的沸点高于乙硫醇,故答案为:乙醇分子间存在氢键;
(5)①根据图示,A(0,0,0),A为坐标原点,B![]() ,B在底面的中心,则边长为1,C在体心,因此C的坐标参数为(
,B在底面的中心,则边长为1,C在体心,因此C的坐标参数为(![]() ,
,![]() ,
,![]() ),故答案为:(
),故答案为:(![]() ,
,![]() ,
,![]() );
);
②在PbS晶胞中Pb2+与周围的6个S2-的距离相等且最小,配位数为6;晶胞中S2-采用面心立方最密堆积方式,晶胞参数为a=0.594 n m,则4r(S2-)=![]() ×0.594nm,解得r(S2-)=0.210 nm,故答案为:6;0.210;
×0.594nm,解得r(S2-)=0.210 nm,故答案为:6;0.210;
③PbS晶胞具有NaC1型结构,PbS晶胞中含有阴阳离子数目相等,如S2-的个数=12×![]() +1=4,,则晶体的密度=
+1=4,,则晶体的密度=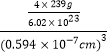 =
=![]() g·cm-3,故答案为:
g·cm-3,故答案为:![]() 。
。