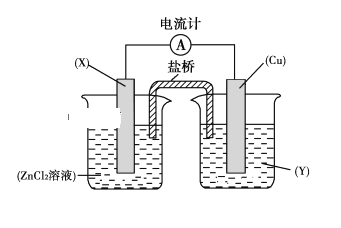
题目内容
【题目】实验室用KClO3分解(MnO2做催化剂)制取氧气,实验后回收剩余固体中的MnO2,正确的操作步骤是
A. 溶解、过滤、蒸发 B. 溶解、过滤、洗涤、干燥
C. 溶解、过滤、结晶 D. 溶解、结晶、干燥
【答案】B
【解析】
试题加热氯酸钾和二氧化锰的混合物的残余物是可溶性的氯化钾和难溶性的二氧化锰,因此可以通过过滤的方法分离提纯;因此要从反应后的残余物中回收MnO2,可以通过溶解然后过滤的方法得到二氧化锰,然后对二氧化锰进行洗涤后烘干即可得到干燥的二氧化锰,因此经过的操作步骤是溶解、过滤、洗涤、干燥,答案选B。

【题目】化学反应速率和限度与生产、生活密切相关.
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水法收集反应放出的氢气,实验记录如下(累计值):
时间 | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标况) | 100 | 240 | 464 | 576 | 620 |
①哪一段时间内反应速率最大:____min(填“0~1”“1~2”“2~3”“3~4”或“4~5”)。
②3~4min内以盐酸的浓度变化来表示的该反应速率______(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积.他事先在盐酸中加入等体积的下列溶液以减慢反应速率但不影响生成氢气的量.你认为不可行的是____(填字母)。
A 蒸馏水 B KCl洛液 C 浓盐酸 D CuSO4溶液
(3)在4L密闭容器中,X、Y、Z三种气体的物质的量随时间变化曲线如图。

①该反应的化学方程式是_______________。
②该反应达到平衡状态的标志是___________(填字母)。
A Y的体积分数在混合气体中保持不变 B X,、Y的反应速率比为3:1
C 容器内气体压强保持不变 D 容器内气体的总质量保持不变
E 生成1molY的同时消耗2molZ
③2min内Y的转化率为__________。
【题目】下列反应中,相关示意图像错误的是
A | B | C | D |
将二氧化硫通入到 一定量氯水中 | 将氨水滴入到一定量氯化铝溶液中 | 将铜粉加入到一定量 浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
|
|
|
|
A. A B. B C. C D. D