题目内容
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是
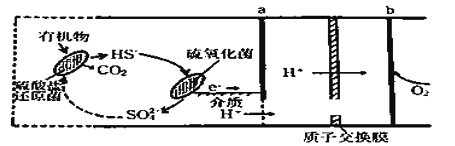
A. HS-在硫氧化菌作用下转化为SO42-的反应为:HS-+4H2O-8e-== SO42-+9H+
B. 电子从b流出,经外电路流向a
C. 如果将反应物直接燃烧,能量的利用率不会变化
D. 若该电池电路中有0.4mol电子发生转移,则有0.45molH+通过质子交换膜
【答案】A
【解析】
由图可以知道硫酸盐还原菌可以将有机物氧化成二氧化碳,而硫氧化菌可以将硫氢根离子氧化成硫酸根离子,所以两种细菌存在,就会循环把有机物氧化成CO2放出电子,负极上HS-,硫氧化菌作用下转化为SO42—,失电子发生氧化反应,电极反应式是:HS-![]() 4H2O-8e-=SO42-
4H2O-8e-=SO42-![]() 9H+;正极上是氧气得电子的还原反应:4H+
9H+;正极上是氧气得电子的还原反应:4H+![]() O2
O2![]() 4e-=2H2O。
4e-=2H2O。
A.负极上HS-在硫氧化菌作用下转化为SO42-。失电子发生氧化反应,电极反应式是HS-![]() 4H2O-8e-=SO42-
4H2O-8e-=SO42-![]() 9H+,故A正确;
9H+,故A正确;
B.b是电池的正极,a是负极。所以电子从a流出,经外电路流向b,,故B错误;
C.如果将反应物直接燃烧,高温下微生物被杀死,效率更低,故C错误;
D.根据电子守恒,若该电池有0.4mol电子转移,有0.4molH+通过质子交换膜,故D错误;
本题答案为A。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案【题目】纳米级Cu2O由于具有优良的催化性能而受到科学家的不断关注,下列为制取Cu2O的三种方法:
方法Ⅰ | 用碳粉在高温条件下还原CuO |
方法Ⅱ | 电解法,原理为2Cu+H2O |
方法Ⅲ | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是_________________________ 。
(2)方法Ⅱ利用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为______________________________ ;电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解,通过离子交换膜的阴离子的物质的量为________mol。(离子交换膜只允许OH-通过)
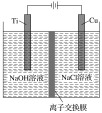
(3)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制的Cu(OH)2来制备纳米级Cu2O,同时放出N2。生成1molN2时,生成Cu2O的物质的量为________________。
(4)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。写出肼-空气燃料电池放电时负极的电极反应式:___________________________。