题目内容
【题目】电解原理在工业生产中有广泛的应用。
(1)请写出电解熔融氯化钠的反应方程式______________________________。如图为离子交换膜法电解饱和食盐水的原理示意图,下列说法正确的是________。
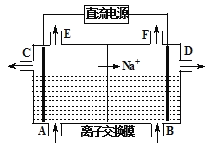
A.直流电源的左侧为负极
B.从E口逸出的气体是H2
C.从B口加入含少量NaOH的水溶液以增强导电性
D.从C口出来的溶液为NaOH溶液
E.每生成22.4 L Cl2,便产生2 mol NaOH
F.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加Na2CO3溶液
G.该离子交换膜为阳离子交换膜
(2)双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2只为还原产物),其电解的化学方程式为3H2O+3O2![]() O3+3H2O2。则阳极的电极反应式为__________________________,阴极的电极反应式____________________。
O3+3H2O2。则阳极的电极反应式为__________________________,阴极的电极反应式____________________。
(3)高铁酸钾(K2FeO4)易溶于水,具有强氧化性,是一种新型水处理剂。工业上用如下方法制备高铁酸钾:以Fe2O3为阳极电解KOH溶液,电解制高铁酸钾时阳极的电极反应式为______________________________。高铁酸钾长期放置会产生红色絮状物及气泡,则该过程的离子方程式_______________________。
【答案】2NaCl(熔融)![]() 2Na+Cl2↑ CG 3H2O-6e-=O3+6H+ O2+2e-+2H+=H2O2(或3O2+6e-+6H+=3H2O2) Fe2O3+10OH--6e-=2FeO42-+5H2O 4FeO42-+10H2O=4Fe(OH)3↓+8OH-+3O2↑
2Na+Cl2↑ CG 3H2O-6e-=O3+6H+ O2+2e-+2H+=H2O2(或3O2+6e-+6H+=3H2O2) Fe2O3+10OH--6e-=2FeO42-+5H2O 4FeO42-+10H2O=4Fe(OH)3↓+8OH-+3O2↑
【解析】
(1)根据电解池中的阳离子移向阴极,因此右边电极是阴极,氢离子得电子生成氢气,同时OH-离子剩余;氯离子在左侧阳极失电子生成氯气,所以直流电源的右侧为负极,左侧为正极,据此分析判断;
(2)根据3H2O+3O2![]() O3+3H2O2可知阳极发生氧化反应,阴极发生还原反应来书写;
O3+3H2O2可知阳极发生氧化反应,阴极发生还原反应来书写;
(3)Fe2O3作阳极制得的高铁酸钾,电极反应为:Fe2O3+10OH--6e-=2FeO42-+5H2O;
根据电子得失知氢氧化铁与氧气物质的量之比为4:3,书写离子方程式。
(1)电解熔融氯化钠生成钠和氯气,反应方程式为:2NaCl(熔融)![]() 2Na+Cl2↑;
2Na+Cl2↑;
电解池中的阳离子移向阴极,因此右边电极是阴极,生成氢气,OH-离子在右侧生成,氯气在左侧生成,直流电源的右侧为负极,故A、B错误,C正确,从D口出来的溶液为NaOH溶液,故D错误,由于没有给出氯气所处的外界条件,则不能根据其体积求算物质的量,故E错误,粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时氯化钡加在Na2CO3溶液之前,这样过量的氯化钡可被碳酸钠除去,故F错误,G正确;故正确的是CG,故答案为:2NaCl(熔融)![]() 2Na+Cl2↑;CG。
2Na+Cl2↑;CG。
(2)因为总反应为3H2O+3O2![]() O3+3H2O2,又阳极发生氧化反应,电极反应式为3H2O-6e-=O3+6H+,阴极发生还原反应,电极反应式为O2+2e-+2H+=H2O2(或3O2+6e-+6H+=3H2O2),故答案为:3H2O-6e-=O3+6H+,O2+2e-+2H+=H2O2(或3O2+6e-+6H+=3H2O2)。
O3+3H2O2,又阳极发生氧化反应,电极反应式为3H2O-6e-=O3+6H+,阴极发生还原反应,电极反应式为O2+2e-+2H+=H2O2(或3O2+6e-+6H+=3H2O2),故答案为:3H2O-6e-=O3+6H+,O2+2e-+2H+=H2O2(或3O2+6e-+6H+=3H2O2)。
(3)Fe2O3作阳极制得的高铁酸钾,电极反应为:Fe2O3+10OH--6e-=2FeO42-+5H2O;因为高铁酸钾溶液长时间放置不稳定,会产生红色絮状物质及气泡知生成氢氧化铁和氧气,由电子得失知二者的比为4:3,则反应的离子方程式是4FeO42-+10H2O=4Fe(OH)3↓+8OH-+3O2↑,故答案为:Fe2O3+10OH--6e-=2FeO42-+5H2O,4FeO42-+10H2O=4Fe(OH)3↓+8OH-+3O2↑。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案