题目内容
在实验室里用铁屑、氧化铜、稀硫酸为原料制取铜,有下列两种途径:
(1)Fe
H2
Cu
(2)CuO
CuSO4
Cu
若用这两种方法制得等量的铜,则下列有关说法符合实际情况的是( )
(1)Fe
| H2SO4 |
| CuO |
(2)CuO
| H2SO4 |
| Fe |
若用这两种方法制得等量的铜,则下列有关说法符合实际情况的是( )
分析:利用两种途径的过程,书写相应的化学方程式,根据反应的物质之间量的关系进行判断,从氢气还原氧化铜,氢气必须过量,所以要使用更多锌更多硫酸,制取相同质量的铜,铜只来源于氧化铜,所以消耗的氧化铜质量相等,利用这些关系解决此题.
解答:解:①Fe+H2SO4=FeSO4+H2↑,H2+CuO
H2O+Cu 生成1份Cu需要1份CuO和1份H2SO4和1份Fe;
②CuO+H2SO4=CuSO4+H2O,CuSO4+Fe=Cu+FeSO4 生成1份Cu需要1份CuO和1份H2SO4和1份Fe;
A、因为整个制备过程中,所有Cu元素都能形成单质Cu,而都来自CuO,没有损失,所以①②氧化铜质量相同,故A正确;
B、这两种方法制得等量的铜,看上去都是相同的.特别注意用H2还原氧化铜的时候,需要先通H2然后加热,以将空气从玻璃管中排出.如果不排出,会引起爆炸,所以H2的量要多一些,自然H2SO4和Fe的量也要多一些,故B错误;
C、H2还原氧化铜的时候,需要先通H2然后加热,以将空气从玻璃管中排出.如果不排出,会引起爆炸,所以H2的量要多一些,自然H2SO4和Fe的量也要多一些,故C错误;
D、H2还原氧化铜的时候,需要先通H2然后加热,以将空气从玻璃管中排出.如果不排出,会引起爆炸,所以H2的量要多一些,自然H2SO4和Fe的量也要多一些,同时生成的硫酸亚铁质量可能不同,故D错误;
故选:A.
| ||
②CuO+H2SO4=CuSO4+H2O,CuSO4+Fe=Cu+FeSO4 生成1份Cu需要1份CuO和1份H2SO4和1份Fe;
A、因为整个制备过程中,所有Cu元素都能形成单质Cu,而都来自CuO,没有损失,所以①②氧化铜质量相同,故A正确;
B、这两种方法制得等量的铜,看上去都是相同的.特别注意用H2还原氧化铜的时候,需要先通H2然后加热,以将空气从玻璃管中排出.如果不排出,会引起爆炸,所以H2的量要多一些,自然H2SO4和Fe的量也要多一些,故B错误;
C、H2还原氧化铜的时候,需要先通H2然后加热,以将空气从玻璃管中排出.如果不排出,会引起爆炸,所以H2的量要多一些,自然H2SO4和Fe的量也要多一些,故C错误;
D、H2还原氧化铜的时候,需要先通H2然后加热,以将空气从玻璃管中排出.如果不排出,会引起爆炸,所以H2的量要多一些,自然H2SO4和Fe的量也要多一些,同时生成的硫酸亚铁质量可能不同,故D错误;
故选:A.
点评:此题是对两种不同途径制取物质的考查,解题的突破口是根据变化过程分析相关量的关系,找到较为简洁的判断方法,是一道训练学生分析问题能力的一道综合题.

练习册系列答案
相关题目
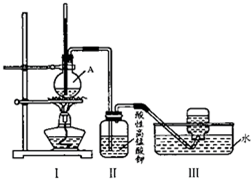 某学习小组在实验室里用乙醇与浓硫酸混合加热制乙烯,并进行有关乙烯性质的探究.装置如图.
某学习小组在实验室里用乙醇与浓硫酸混合加热制乙烯,并进行有关乙烯性质的探究.装置如图.


 H2
H2 Cu
Cu Cu
Cu