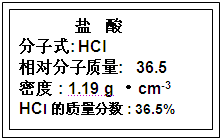
题目内容
取少量Fe2O3粉末(红棕色)加入适量盐酸,发生反应的化学方程式:
(1)取少量溶液置于试管中,滴入几滴NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为
(2)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈
(3)取另一只小烧杯也加入20mL蒸馏水,向烧杯中加入1mL FeCl3溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到
(4)取乙烧杯中少量Fe(OH)3胶体置于试管中,向试管中滴加一定量的稀HI溶液,边滴加边振荡,会出现一系列变化.
①先出现红褐色沉淀,随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式:
②最后溶液颜色加深,原因是
③用稀盐酸代替稀HI溶液,能出现上述哪些相同的变化现象
Fe2O3+6HCl═2FeCl3+3H2O
Fe2O3+6HCl═2FeCl3+3H2O
,反应后得到的溶液呈棕黄
棕黄
色.用此溶液分别做如下实验:(1)取少量溶液置于试管中,滴入几滴NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为
FeCl3+3NaOH═3NaCl+Fe(OH)3↓
FeCl3+3NaOH═3NaCl+Fe(OH)3↓
,此反应属于复分解反应
复分解反应
.(2)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈
红褐
红褐
色,即制得Fe(OH)3胶体.(3)取另一只小烧杯也加入20mL蒸馏水,向烧杯中加入1mL FeCl3溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到
乙
乙
烧杯中的液体产生丁达尔效应.这个实验可以用来区别胶体和溶液
胶体和溶液
.(4)取乙烧杯中少量Fe(OH)3胶体置于试管中,向试管中滴加一定量的稀HI溶液,边滴加边振荡,会出现一系列变化.
①先出现红褐色沉淀,随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式:
Fe(OH)3+3H+═Fe3++3H2O
Fe(OH)3+3H+═Fe3++3H2O
;②最后溶液颜色加深,原因是
2Fe3++2I-═I2+2Fe2+
2Fe3++2I-═I2+2Fe2+
(用离子方程式表示).③用稀盐酸代替稀HI溶液,能出现上述哪些相同的变化现象
①
①
(写序号).分析:Fe2O3是碱性氧化物,可以与酸反应生成盐和水;
(1)向FeCl3溶液中滴入NaOH溶液,二者之间会发生复分解反应;
(2)根据Fe(OH)3胶体的制法:向沸水中滴加饱和的氯化铁溶液;
(3)胶体可发生丁达尔效应,而溶液不能,利用这一点可以区分胶体和溶液;
(4)HI既有酸性又有强还原性,I-能使Fe(OH)3胶体聚沉,H+使其溶解,生成的Fe3+又能氧化I-生成I2;而HCl只能使其先聚沉再溶解.该题涉及胶体的聚沉、Fe(OH)3的碱性、HI是强电解质、具有酸性、还原性等性质.分析③时的关键在于Cl-比I-还原性弱,Cl-不能还原Fe3+,故导致现象不同.
(1)向FeCl3溶液中滴入NaOH溶液,二者之间会发生复分解反应;
(2)根据Fe(OH)3胶体的制法:向沸水中滴加饱和的氯化铁溶液;
(3)胶体可发生丁达尔效应,而溶液不能,利用这一点可以区分胶体和溶液;
(4)HI既有酸性又有强还原性,I-能使Fe(OH)3胶体聚沉,H+使其溶解,生成的Fe3+又能氧化I-生成I2;而HCl只能使其先聚沉再溶解.该题涉及胶体的聚沉、Fe(OH)3的碱性、HI是强电解质、具有酸性、还原性等性质.分析③时的关键在于Cl-比I-还原性弱,Cl-不能还原Fe3+,故导致现象不同.
解答:解:Fe2O3是碱性氧化物,可以与盐酸反应生成氯化铁和水,即Fe2O3+6HCl═2FeCl3+3H2O,氯化铁溶液呈现棕黄色,故答案为:Fe2O3+6HCl═2FeCl3+3H2O;棕黄;
(1)向FeCl3溶液中滴入NaOH溶液发生复分解反应:FeCl3+3NaOH═3NaCl+Fe(OH)3↓,故答案为:FeCl3+3NaOH═3NaCl+Fe(OH)3↓;复分解反应;
(2)Fe(OH)3胶体的制法:向沸水中滴加饱和的氯化铁溶液,直到出现红褐色胶体为止,故答案为:红褐;
(3)胶体乙可发生丁达尔效应,而溶液不能,利用这一点可以区分胶体和溶液,故答案为:乙;胶体和溶液;
(4)①Fe(OH)3胶体置于试管中,向试管中滴加一定量的稀HI溶液,会使得胶体聚沉,出现红褐色沉淀,然后生成的氢氧化铁溶解于氢碘酸中,发生中和反应,即Fe(OH)3+3H+═Fe3++3H2O,生成的铁离子使得溶液呈黄色,故答案为:Fe(OH)3+3H+═Fe3++3H2O;
②铁离子具有氧化性,碘离子具有还原,二者之间发生氧化还原反应生成单质碘和亚铁离子,2Fe3++2I-═I2+2Fe2+,所以最后溶液颜色加深,故答案为:2Fe3++2I-═I2+2Fe2+;
③用稀盐酸代替稀HI溶液,Cl-比I-还原性弱,Cl-不能还原Fe3+,不会发生铁离子的还原反应,只会出现红褐色沉淀,随后沉淀溶解,溶液呈黄色的现象,故答案为:①.
(1)向FeCl3溶液中滴入NaOH溶液发生复分解反应:FeCl3+3NaOH═3NaCl+Fe(OH)3↓,故答案为:FeCl3+3NaOH═3NaCl+Fe(OH)3↓;复分解反应;
(2)Fe(OH)3胶体的制法:向沸水中滴加饱和的氯化铁溶液,直到出现红褐色胶体为止,故答案为:红褐;
(3)胶体乙可发生丁达尔效应,而溶液不能,利用这一点可以区分胶体和溶液,故答案为:乙;胶体和溶液;
(4)①Fe(OH)3胶体置于试管中,向试管中滴加一定量的稀HI溶液,会使得胶体聚沉,出现红褐色沉淀,然后生成的氢氧化铁溶解于氢碘酸中,发生中和反应,即Fe(OH)3+3H+═Fe3++3H2O,生成的铁离子使得溶液呈黄色,故答案为:Fe(OH)3+3H+═Fe3++3H2O;
②铁离子具有氧化性,碘离子具有还原,二者之间发生氧化还原反应生成单质碘和亚铁离子,2Fe3++2I-═I2+2Fe2+,所以最后溶液颜色加深,故答案为:2Fe3++2I-═I2+2Fe2+;
③用稀盐酸代替稀HI溶液,Cl-比I-还原性弱,Cl-不能还原Fe3+,不会发生铁离子的还原反应,只会出现红褐色沉淀,随后沉淀溶解,溶液呈黄色的现象,故答案为:①.
点评:本题考查学生胶体的性质、制备以及胶体和溶液的鉴别等方面的知识,注意知识的迁移和应用是解题关键,难度不大.

练习册系列答案
相关题目