题目内容
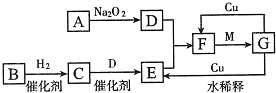 如图表示由短周期元素组成的一些物质之间的转化关系(某些反应产物已略去).各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体.
如图表示由短周期元素组成的一些物质之间的转化关系(某些反应产物已略去).各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体.(1)物质F的化学式:
NO2
NO2
.(2)物质B的电子式:
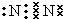
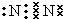
(3)写出C→E的化学方程式:
4NH3+5O2
4NO+6H2O
| ||
| 高温高压 |
4NH3+5O2
4NO+6H2O
.
| ||
| 高温高压 |
(4)写出G→E的离子方程式:
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.分析:C是使湿润的红色石蕊试纸变蓝的气体,应为NH3,则B为N2,E为NO,G为HNO3,F为NO2,M是最常见的无色液体,应为H2O,A为可与过氧化钠反应的气体,应为CO2,结合对应物质的性质以及题目要求解答该题.
解答:解:C是使湿润的红色石蕊试纸变蓝的气体,应为NH3,则B为N2,E为NO,G为HNO3,F为NO2,M是最常见的无色液体,应为H2O,A为可与过氧化钠反应的气体,应为CO2,
(1)由以上分析可知F为NO2,故答案为:NO2;
(2)由以上分析可知B为N2,电子式为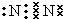 ,故答案为:
,故答案为: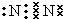 ;
;
(3)C为NH3,在催化作用下与氧气反应可生成NO,为工业制硝酸的重要反应,反应的化学方程式为
4NH3+5O2
4NO+6H2O,
故答案为:4NH3+5O2
4NO+6H2O;
(4)G为HNO3,加水稀释成稀硝酸,可与铜反应生成NO,反应的化学方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(1)由以上分析可知F为NO2,故答案为:NO2;
(2)由以上分析可知B为N2,电子式为
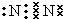 ,故答案为:
,故答案为: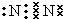 ;
;(3)C为NH3,在催化作用下与氧气反应可生成NO,为工业制硝酸的重要反应,反应的化学方程式为
4NH3+5O2
| ||
| 高温高压 |
故答案为:4NH3+5O2
| ||
| 高温高压 |
(4)G为HNO3,加水稀释成稀硝酸,可与铜反应生成NO,反应的化学方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
点评:本题考查无机物的推断,侧重于元素化合物知识的考查,注意把握相关物质的性质以及转化反应的化学方程式的书写,解答本题的突破口为C和M的性质,答题时注意体会,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 2NH3
2NH3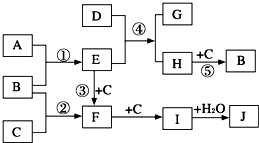 (2009?开封一模)如图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去).
(2009?开封一模)如图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去). 如图表示由短周期元素组成的一些物质之间的转化关系(某些反应产物已略去).各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体.
如图表示由短周期元素组成的一些物质之间的转化关系(某些反应产物已略去).各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体.