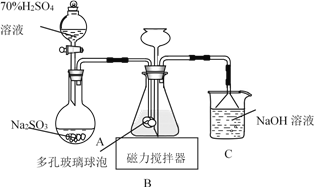
��Ŀ����
����Ŀ���ѱ���Ϊ��21���͵Ľ��������ɳ��ֶ��ֻ��ϼۡ�������+4�۵�Ti��Ϊ�ȶ���
��1����̬Tiԭ�ӵļ۵��ӹ����ʾʽΪ_______________��
��2����֪�����ܣ�I2��Ti����1310kJ/mol��I2��K����3051kJ/mol��I2��Ti����I2��K������ԭ��Ϊ________��
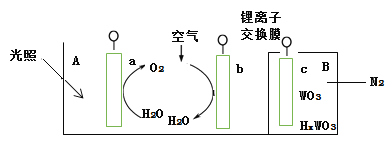
��3����ij���������ڴ���ϩ���ۺϣ������ͼ��ʾ��
���ѵ���λ��Ϊ_____��̼ԭ�ӵ��ӻ�����_____��
�ڸ�������д��ڵĻ�ѧ����___________������ĸ��ţ���
a�����ӽ� b����λ�� c�������� d�����ۼ� e�����
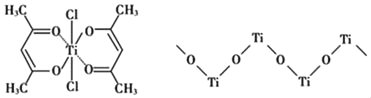
��4����֪TiO2��Ũ���ᷴӦ�����������ѣ��������Ѿ�����������Ϊ��״�ۺ���ʽ�����ӣ��ṹ����ͼ��ʾ���������ӻ�ѧʽΪ________��������SO42���Ŀռ乹��Ϊ____��
��5������±���γɵĻ������۷е����±���ʾ��
TiCl4 | TiBr4 | TiI4 | |
�۵�/�� | ��24.1 | 38.3 | 155 |
�е�/�� | 136.5 | 233.5 | 377 |
���� TiCl4��TiBr4��TiI4���۵�ͷе����һ���仯���ɵ�ԭ���ǣ�_____��
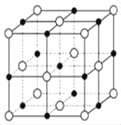
��6����֪TiN����ľ����ṹ����ͼ��ʾ�����þ������ܶ���g/cm3�������ӵ�����ֵΪNA������Tiԭ����Nԭ�ӵ��������Ϊ________pm�����ú�����NA�Ĵ���ʽ��ʾ��
���𰸡� K+�ĵ����Ų�ʽΪ3p6��3p�������ȫ����״̬����Խ��ȶ�������ʧȥ����Ti+ʧȥ����4s1���� 6 sp3��sp2 bd TiO2+��TiO��n2n+ �������� ���߶��Ƿ��Ӿ��壬��ɺͽṹ���ƣ�������Է������������Ӽ���������ǿ���۷е�����
K+�ĵ����Ų�ʽΪ3p6��3p�������ȫ����״̬����Խ��ȶ�������ʧȥ����Ti+ʧȥ����4s1���� 6 sp3��sp2 bd TiO2+��TiO��n2n+ �������� ���߶��Ƿ��Ӿ��壬��ɺͽṹ���ƣ�������Է������������Ӽ���������ǿ���۷е����� ![]() ��1010
��1010
��������
��1��Tiԭ����3d��4s�ܼ��ϵ���Ϊ��۵��ӣ�
��2������е��Ӵ���ȫ����ȫ�ջ����ʱ���ȶ���
��3���ٸ���ͼ֪��Tiԭ����λ����6�����ϵ�Cԭ�Ӽ۲���Ӷ�����4������Cԭ�Ӽ۲���Ӷ�����3�����ݼ۲���ӶԻ��������ж�Cԭ���ӻ����ͣ�
��Tiԭ�Ӻ���ԭ�ӡ�Oԭ��֮�������λ����̼�⡢̼̼��̼��ԭ��֮����ڹ��ۼ���
��4������������ÿ��Ti4+���������Ӹ���=2��![]() =1�������������Sԭ�Ӽ۲���Ӷ���=4+��6+2-4��2����2=4���Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������жϸ����ӿռ乹�ͣ�
=1�������������Sԭ�Ӽ۲���Ӷ���=4+��6+2-4��2����2=4���Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������жϸ����ӿռ乹�ͣ�
��5���⼸�������۷е�ϵͣ�Ϊ���Ӿ��壬��ɺͽṹ���Ƶķ��Ӿ��壬���۷е�����Ӽ������������ȣ����Ӽ�������������Է����������������
��6����ɫ�����=8��![]() +6��
+6��![]() =4����ɫ�����=12��
=4����ɫ�����=12��![]() +1=4�������ⳤ=
+1=4�������ⳤ= ��������Tiԭ����Nԭ�ӵ��������Ϊ�ⳤ��һ�롣
��������Tiԭ����Nԭ�ӵ��������Ϊ�ⳤ��һ�롣
(1)Tiԭ����3d��4s�ܼ��ϵ���Ϊ��۵��ӣ�Ti�ļ۵����Ų�ʽΪ3d24s2����۵����Ų�ͼΪ ��
��
�ʴ�Ϊ�� ��
��
(2)����е��Ӵ���ȫ����ȫ�ջ����ʱ���ȶ���K+ʧȥ����ȫ������3p6���ӣ�Ti+ʧȥ����4s1���ӣ�ʧ����ǰ�߽Ϻ����ѣ�����I2(Ti)<I2(K)��
�ʴ�Ϊ��K+�ĵ����Ų�ʽΪ3p6��3p�������ȫ����״̬����Խ��ȶ�������ʧȥ����Ti+ʧȥ����4s1���ӣ�
(3)�ٸ���ͼ֪��Tiԭ����λ����6�����ϵ�Cԭ���γ�4�������Ҳ����µ��Ӷԣ��۲���Ӷ�����4������CΪsp3�ӻ�������Cԭ���γ�3��������1���������Ҳ����µ��Ӷԣ��۲���Ӷ�����3������CΪsp2�ӻ���
�ʴ�Ϊ��6��sp3��sp2��
��Tiԭ�Ӻ���ԭ�ӡ�Oԭ��֮�������λ����̼�⡢̼̼��̼��ԭ��֮����ڹ��ۼ������Ժ��еĻ�ѧ��Ϊ��λ�����ۼ���
�ʴ�Ϊ��bd��
(4) ����������ÿ��Ti4+���������Ӹ���=2��![]() =1���������ӻ�ѧʽΪTiO2+��(TiO) n 2n+�������������Sԭ�Ӽ۲���Ӷ���=4+��6+2-4��2����2=4���Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������жϸ����ӿռ乹��Ϊ���������Σ�
=1���������ӻ�ѧʽΪTiO2+��(TiO) n 2n+�������������Sԭ�Ӽ۲���Ӷ���=4+��6+2-4��2����2=4���Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������жϸ����ӿռ乹��Ϊ���������Σ�
�ʴ�Ϊ��TiO2+��(TiO) n 2n+���������壻
(5) �⼸�������۷е�ϵͣ���Ϊ���Ӿ��壬��ɺͽṹ���Ƶķ��Ӿ��壬���۷е�����Ӽ������������ȣ����Ӽ�������������Է�����������������⼸�ַ�����Է����������Ȼ��ﵽ�⻯�����������Ӽ��������������������۷е��������ߣ�
�ʴ�Ϊ�����߶��Ƿ��Ӿ��壬��ɺͽṹ���ƣ�������Է������������Ӽ���������ǿ���۷е����ߣ�
(6) ��ɫ�����=8��![]() +6��
+6��![]() =4����ɫ�����span>=12��
=4����ɫ�����span>=12��![]() +1=4�������ⳤ=
+1=4�������ⳤ= cm��������Tiԭ����Nԭ�ӵ��������Ϊ�ⳤ��һ��=
cm��������Tiԭ����Nԭ�ӵ��������Ϊ�ⳤ��һ��=![]() ��
�� cm =
cm =![]() ��
�� cm=
cm=![]() ��1010pm����
��1010pm����
�ʴ�Ϊ��![]() ��1010��
��1010��

 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�����Ŀ��2009��10��1�գ��ҹ��ɹ��ٰ������ʮ���ı���������ı���ʽ��9���綯�����϶�����������Դ���������࣬չʾ���ۺϹ����������Ƽ���չˮƽ��ͬʱҲ˵����Դ��ȱ������������ٵ��ش����⡣�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧ�� CO(g) �� 2H2(g)![]() CH3OH(g) ��H1
CH3OH(g) ��H1
��Ӧ�� CO2(g) �� 3H2(g)![]() CH3OH(g) + H2O(g) ��H2
CH3OH(g) + H2O(g) ��H2
��������Ӧ������ԭ�Ӿ�����ԭ����� _____����������������������
���±����������Ƿ�Ӧ���ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
�¶� | 250�� | 300�� | 350�� |
K | 2.041 | 0.270 | 0.012 |
�ɱ��������ж���H1 0 ������������������������������
��ij�¶��£���2 mol CO��6 mol H2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO)�� 0.2 mol/L����CO��ת����Ϊ ����ʱ���¶�Ϊ �����ϱ���ѡ��
��2����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g) ��H1����1275.6 kJ/mol
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H2����566.0 kJ/mol
�� H2O(g) �� H2O(l) ��H3����44.0 kJ/mol
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��
��3��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ����
�������ͼ��ʾ�ĵ��װ�á��õ�������ĵ缫��ӦΪ ��

�ڹ���һ��ʱ������Һ��pH��С���õ���ܷ�Ӧ�Ļ�ѧ����ʽΪ
��
����Ŀ���ڼס��ҡ����������º��ݵ��ܱ������У��ֱ������������̿��һ������NO��������ӦC(s)��2NO(g)![]() N2(g)��CO2(g)����ø�������c(NO)�淴Ӧʱ��t�ı仯������±���ʾ������˵����ȷ����
N2(g)��CO2(g)����ø�������c(NO)�淴Ӧʱ��t�ı仯������±���ʾ������˵����ȷ����
�������¶ȣ� | t(min) c(molL-1) | 0 | 40 | 80 | 120 | 160 |
�ף�400�棩 | c(NO) | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
�ң�400�棩 | c(NO) | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
����T�棩 | c(NO) | 2.00 | 1.40 | 1.10 | 1.10 | 1.10 |
A.�ﵽƽ��״̬ʱ��2v��c(NO)��v��c(N2)
B.������ѹǿ���ٸı�˵����Ӧ�Ѵ�ƽ��
C.�������дӷ�Ӧ��ʼ������ƽ���ƽ����Ӧ����v c(NO)��0.01125 mol��L��1��min��1
D.�ɱ������ݿ�֪��T>400