题目内容
19.(4)某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下系列实验,实验结果记录如下,试根据表中的实验现象书写出第四级和第五组实验Al电极的电极反应式:| 编号 | 电极材料 | 电解制溶液 | 电流指针偏转方向 |
| 1 | Mg Al | 稀盐酸 | 偏向Al |
| 2 | Al Cu | 稀盐酸 | 偏向Cu |
| 3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Zn | 浓硝酸 | 偏向Al |
分析 ④实验4中发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,Al失去电子,则Al为负极;实验5中Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,所以电流计指针偏向铝;
解答 解:④实验4中Mg不与naOH溶液发生反应,而发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,Al失去电子,则Al为负极,负极反应为Al-3e-+4OH-═AlO2-+2H2O,实验5中Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,所以电流计指针偏向铝;正极是2H++NO3-+e-=NO2+H2O,
故答案为:Al-3e-+4OH-═AlO2-+2H2O;2H++NO3-+e-=NO2+H2O.
点评 本题考查原电池原理,明确发生的原电池反应及正负极的判断是解答本题的关键,题目难度不大,注意利用氧化还原反应中电子的得失来分析正负极.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
9.在一密闭容器中,CO和H2O混合加热到800℃达到下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),K=1.0,若反应开始时CO和H2O的浓度分别为0.20mol/L和1.00mol/L,则CO转化为CO2的转化率为( )
| A. | 80% | B. | 83% | C. | 75% | D. | 91% |
10.在蒸发皿中蒸干下列物质的溶液,不能得到该物质固体的是( )
| A. | MgCl2 | B. | Fe2(SO4)3 | C. | K2CO3 | D. | NaCl |
14.下列关于有机化合物说法正确的是( )
| A. | 可用高锰酸钾溶液鉴别甲苯、环己烯与溴苯 | |
| B. | 淀粉与纤维素互为同分异构体,二者水解的最终产物相同 | |
| C. | 石油裂解和油脂皂化都是由高分子化合物生成小分子物质的过程 | |
| D. | 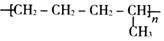 是由单体CH2=CH-CH3和CH2=CH2发生加聚反应的产物 是由单体CH2=CH-CH3和CH2=CH2发生加聚反应的产物 |
4.已知:R-C≡C-H+R'Br $\stackrel{一定条件}{→}$R-C≡C-R'+HBr (R,R'+表示氢原子或羟基),利用该反应合成导电高分子材料P的结构式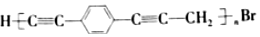 .下列说法正确的是( )
.下列说法正确的是( )
 .下列说法正确的是( )
.下列说法正确的是( )| A. | 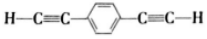 和苯乙炔互为同系物 和苯乙炔互为同系物 | |
| B. | 炔烃和卤代烃在一定条件下可发生取代反应 | |
| C. | 高分子材料P不指使溴的四氯化碳溶液褪色 | |
| D. | 生成P的单体是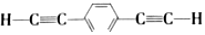 和CH3Br 和CH3Br |
3.下列氯化物中,既能由单质直接化合制得,又可由金属和盐酸反应制得的是( )
| A. | CuCl2 | B. | FeCl2 | C. | FeCl3 | D. | AlCl3 |
4.下列有关仪器的使用方法或实验操作正确的是( )
| A. | 洗净的锥形瓶和容量瓶可以放进烘箱中烘干 | |
| B. | 中和热测定实验的量热计中有少量水不影响测定结果 | |
| C. | 中和滴定实验中,用待装溶液润洗滴定管以减小实验误差 | |
| D. | 硫酸铜结晶水含量测定实验中至少用托盘天平称量3次 |