题目内容
合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.
请回答下列问题:
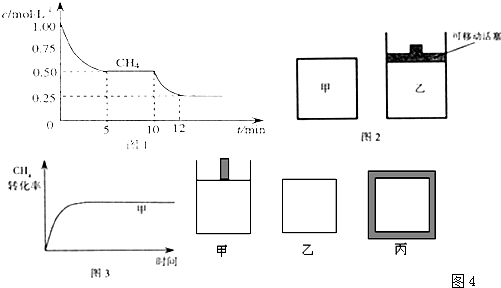
(1)在一密闭容器中进行反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ/mol,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=______;10min时,改变的外界条件可能是______.
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=+247.3kJ/mol,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象.
(3)反应CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ/mol在800℃时的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断.
【答案】分析:(1)根据V= 求出CH4的化学反应速率,然后根据反应速率之比等于化学计量数之比,求出H2的化学反应速率;根据图象可知化学反应速率加快,化学平衡正向移动;
求出CH4的化学反应速率,然后根据反应速率之比等于化学计量数之比,求出H2的化学反应速率;根据图象可知化学反应速率加快,化学平衡正向移动;
(2)由于CH4(g)+CO2(g)?2CO(g)+2H2(g)是气体体积增大的反应,要保持恒压,须扩大容器的体积,对于甲容器来说相当于减压,速率减慢,平衡正向移动;
(3)根据浓度熵Q与平衡常数K的大小来判断v(正)和v(逆)的大小.
解答:解:(1)CH4的化学反应速率为V= =
= =0.1mol/(L?min),根据反应速率之比等于化学计量数之比,H2的化学反应速率为0.3mol/(L?min),故答案为:0.3mol/(L?min);
=0.1mol/(L?min),根据反应速率之比等于化学计量数之比,H2的化学反应速率为0.3mol/(L?min),故答案为:0.3mol/(L?min);
根据图象可知化学反应速率加快,化学平衡正向移动,根据外界条件对化学反应速率的影响和对化学平衡的影响,可用升高温度或充入水蒸气来达到目的,故答案为:升高温度或充入水蒸气;
(2)因CH4(g)+CO2(g)?2CO(g)+2H2(g)是气体体积增大的反应,要保持恒压,须扩大容器的体积,对于甲容器来说相当于减压,速率减慢,平衡正向移动,所以到达平衡的时间长,甲烷的转化率提高,其图象为:
 ,故答案为:
,故答案为: .
.
(3)反应CO(g)+H2O(g)?CO2(g)+H2(g)在某时刻的浓度幂之积为Q= =
= =0.94<1.0,反应正向进行,v(正)>v(逆),故选:a.
=0.94<1.0,反应正向进行,v(正)>v(逆),故选:a.
点评:本题主要考查了化学反应速率的计算、外界条件对化学反应速率和平衡的影响等,难度中等.
 求出CH4的化学反应速率,然后根据反应速率之比等于化学计量数之比,求出H2的化学反应速率;根据图象可知化学反应速率加快,化学平衡正向移动;
求出CH4的化学反应速率,然后根据反应速率之比等于化学计量数之比,求出H2的化学反应速率;根据图象可知化学反应速率加快,化学平衡正向移动;(2)由于CH4(g)+CO2(g)?2CO(g)+2H2(g)是气体体积增大的反应,要保持恒压,须扩大容器的体积,对于甲容器来说相当于减压,速率减慢,平衡正向移动;
(3)根据浓度熵Q与平衡常数K的大小来判断v(正)和v(逆)的大小.
解答:解:(1)CH4的化学反应速率为V=
 =
= =0.1mol/(L?min),根据反应速率之比等于化学计量数之比,H2的化学反应速率为0.3mol/(L?min),故答案为:0.3mol/(L?min);
=0.1mol/(L?min),根据反应速率之比等于化学计量数之比,H2的化学反应速率为0.3mol/(L?min),故答案为:0.3mol/(L?min);根据图象可知化学反应速率加快,化学平衡正向移动,根据外界条件对化学反应速率的影响和对化学平衡的影响,可用升高温度或充入水蒸气来达到目的,故答案为:升高温度或充入水蒸气;
(2)因CH4(g)+CO2(g)?2CO(g)+2H2(g)是气体体积增大的反应,要保持恒压,须扩大容器的体积,对于甲容器来说相当于减压,速率减慢,平衡正向移动,所以到达平衡的时间长,甲烷的转化率提高,其图象为:
 ,故答案为:
,故答案为: .
.(3)反应CO(g)+H2O(g)?CO2(g)+H2(g)在某时刻的浓度幂之积为Q=
 =
= =0.94<1.0,反应正向进行,v(正)>v(逆),故选:a.
=0.94<1.0,反应正向进行,v(正)>v(逆),故选:a.点评:本题主要考查了化学反应速率的计算、外界条件对化学反应速率和平衡的影响等,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料。从天然气获得合成气过程中可能发生的反应有:
① CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+206.1 kJ/mol
CO(g)+3H2(g) ΔH1=+206.1 kJ/mol
② CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH2=+247.3 kJ/mol
2CO(g)+2H2(g) ΔH2=+247.3 kJ/mol
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
请回答下列问题:
⑴ 在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示。反应进行的前5 min内, v(H2)= ▲ ;10 min时,改变的外界条件可能是 ▲ 。
![]()

⑵ 如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中CH4的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图像。

⑶ 反应③中ΔH3= ▲ 。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时反应③中正、逆反应速率的关系式是 ▲ (填代号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断