题目内容
20.A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1molL-1,反应进行2min后A的浓度为0.6molL-1,B的浓度为0.8molL-1,C的浓度为0.6molL-1,则2min内反应的平均速率:v(A)=0.2mol•L-1•min-1,v(B)=0.1mol•L-1•min-1,v(C)=0.3mol•L-1•min-1,该反应的化学方程式是2A+B=3C.分析 根据v=$\frac{△c}{△t}$计算出2min内用物质A、B、C表示的平均反应速率,再利用速率之比等于化学计量数之比确定系数,书写化学反应方程式.
解答 解:v(A)=$\frac{1mol/L-0.6mol/L}{2min}$=0.2mol•L-1•min-1,
v(B)=$\frac{1mol/L-0.8mol/L}{2min}$=0.1 mol•L-1•min-1,
v(C)=$\frac{0.6mol/L}{2min}$=0.3 mol•L-1•min-1,
所以,v(A):v(B):v(C)=0.2 mol•L-1•min-1:0.1mol•L-1•min-1:0.3 mol•L-1•min-1=2:1:3,
化学计量数之比等于速率之比,反应方程式为:2A+B=3C.
故答案为:0.2 mol•L-1•min-1;0.1mol•L-1•min-1;0.3 mol•L-1•min-1;2A+B=3C.
点评 本题考查化学反应速率的有关计算等,题目难度不大,注意基础知识的积累掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.可逆反应达到化学平衡的标志是( )
| A. | 正、逆反应不再进行 | B. | 浓度为零 | ||
| C. | 正、逆反应都还在继续进行 | D. | 正、逆反应的速率相等 |
5.下列表示物质结构的化学用语或模型正确的是( )
| A. | 甲酸甲酯的结构简式:C2H4O2 | B. | H2O2的电子式: | ||
| C. | 中子数为10 的氧原子:188O | D. | 对-硝基甲苯的结构简式: |
12.短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于IA族,W与X属于同一主族.下列说法正确的是( )
| A. | 元素Y、W的简单阴离子具有相同的电子层结构 | |
| B. | 由X、W两种元素组成的化合物是离子化合物 | |
| C. | X的简单气态氢化物的热稳定性比W的强是因为X的氢化物分子间易形成氢键 | |
| D. | 离子半径:r(Z)<r(Y)<r(X)<r(W) |
9.下列过程属于物理变化的是( )
| A. | 石油的分馏 | B. | 石油的裂化 | C. | 煤的干馏 | D. | 乙烯聚合 |
10.下列离子方程式书写正确的是( )
| A. | Ca(HCO3)2 溶液中滴入过量NaOH溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 向NaAlO2 溶液中通入过量的 CO2:CO2+2H2O+A1O2-═Al(OH)3↓+HCO3- | |
| C. | 0.01mol/L NH4Al(SO4)2 溶液与 0.02mol/L Ba(OH)2 溶液等体积混合:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| D. | 向Ca(ClO)2 溶液中通入过量的 SO2:C1O-+SO2+H2O═HClO+HSO3- |
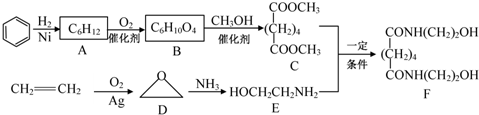
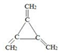
 .
. ,该有机物与H2加成时最多能消耗氢气的物质的量3mol,有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式
,该有机物与H2加成时最多能消耗氢气的物质的量3mol,有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式 ,将Y加入酸性高锰酸钾溶液中的现象酸性高锰酸钾溶液褪色.
,将Y加入酸性高锰酸钾溶液中的现象酸性高锰酸钾溶液褪色.