题目内容
(1)在实验室中用MnO2和浓盐酸反应制备氯气,其反应的化学方程式为:______;
(2)某同学欲制取2.24L(标况)氯气,其做法是称取8.7g 二氧化锰与40mL10mol?L-1 的浓盐酸反应,其做法能否达到目的______(填“能”、“或“不能”).通过计算和文字叙述说明之.
(2)某同学欲制取2.24L(标况)氯气,其做法是称取8.7g 二氧化锰与40mL10mol?L-1 的浓盐酸反应,其做法能否达到目的______(填“能”、“或“不能”).通过计算和文字叙述说明之.
(1)浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水.
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2 ↑+2H2O.
(2)MnO2 +4HCl(浓)
MnCl2+Cl2↑+2H2O
87g 4mol 22.4l
8.7g 0.4mol 2.24L
理论上二氧化锰和浓盐酸恰好反应生成 2.24L氯气,但实际上随着反应的进行,浓盐酸变成稀盐酸,稀盐酸和二氧化锰不反应,所以得不到 2.24L氯气.
故答案为:不能.
故答案为:MnO2+4HCl(浓)
| ||
(2)MnO2 +4HCl(浓)
| ||
87g 4mol 22.4l
8.7g 0.4mol 2.24L
理论上二氧化锰和浓盐酸恰好反应生成 2.24L氯气,但实际上随着反应的进行,浓盐酸变成稀盐酸,稀盐酸和二氧化锰不反应,所以得不到 2.24L氯气.
故答案为:不能.

练习册系列答案
相关题目
铁是一种历史悠久、应用最广泛、用量最大的金属。某实验小组用铁粉进行如下实验。
(1)取少量纯铁粉与足量的稀硫酸反应,在不影响产生氢气总量的情况下,若要加快反应速率,可行的方法有(填序号) 。
① 加热 ② 滴加少量浓硝酸 ③ 滴加少量硫酸铜
(2)甲同学欲用少量纯铁粉与足量浓硫酸反应得到硫酸亚铁。同学们认为不论常温还是加热的条件下均不可行,理由是 。
大家讨论后将上述方案做如下改进后可获得FeSO4?7H2O,请填写下列括号中的空白:

(3)乙同学在实验室中用m g废铁屑(已除去表面的油污)与足量稀硫酸反应,准确测定反应生成氢气的体积,实验数据记录如下:
气体体积/mL | 10 | 20 | 30 |
所用时间/s | 30 | 85 | 165 |
若用每秒产生的气体体积(mL)表示该反应的速率,则30 s至85 s内该反应的速率为 。若完全反应后测得产生气体的体积为V mL (已折算成标准状况),则该废铁屑中铁的质量分数为(用含m、V的代数式表示) 。
若实验操作无误,但测得铁的质量分数总是大于实际值,原因可能是 。
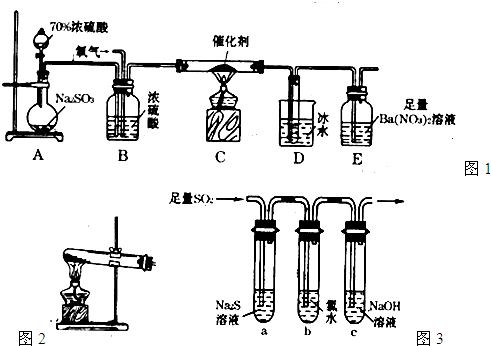
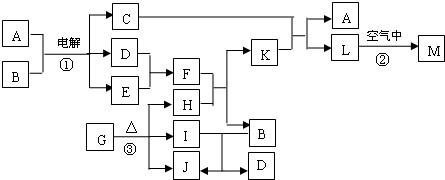
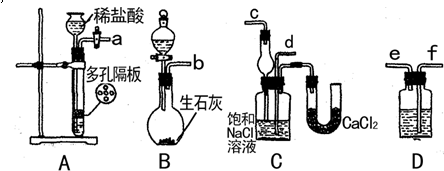
 ,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。
,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。


 ,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。
,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。

