题目内容
若NA表示阿佛加德罗常数,下列说法正确的是( )
| A、1 mol Cl2作为氧化剂得到的电子数为NA |
| B、在0℃,101 kPa时,22.4 L氢气中含有NA个氢原子 |
| C、14 g氮气中含有7 NA个电子 |
| D、NA个一氧化碳分子和0.5 molCH4所含原子数相同 |
考点:阿伏加德罗常数
专题:
分析:A、ACl2作为氧化剂被还原为Cl-;
B、根据n=
计算出氢气的物质的量并结合H2的分子组成来计算;
C、根据氮气的物质的量并结合氮气中的电子个数来计算;
D、NA个CO分子中含2NA个原子,0.5 molCH4所含原子的物质的量为2.5mol.
B、根据n=
| V |
| Vm |
C、根据氮气的物质的量并结合氮气中的电子个数来计算;
D、NA个CO分子中含2NA个原子,0.5 molCH4所含原子的物质的量为2.5mol.
解答:
解:A、Cl2作为氧化剂被还原为Cl-,故1 mol Cl2得2mol电子,即2NA个,故A错误;
B、在0℃、101 kPa时,气体摩尔体积为22.4L/mol,22.4 L氢气的物质的量n=
=
=1mol,含有的氢原子数为2NA个,故B错误;
C、14 g氮气的物质的量n=
=
=0.5mol,而N2中有14个电子,故0.5molN2中含有的电子数N=0.5×14×NA=7NA,故C正确;
D、NA个CO分子中含2NA个原子,0.5 molCH4所含原子的物质的量为2.5mol,即2.5NA个,故D错误;
故选C.
B、在0℃、101 kPa时,气体摩尔体积为22.4L/mol,22.4 L氢气的物质的量n=
| V |
| Vm |
| 22.4L |
| 22.4L/mol |
C、14 g氮气的物质的量n=
| m |
| M |
| 14g |
| 28g/mol |
D、NA个CO分子中含2NA个原子,0.5 molCH4所含原子的物质的量为2.5mol,即2.5NA个,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
下列实验操作中错误的是( )
| A、进行蒸发操作时,应加热至混合物中有大量晶体析出时停止加热,用余热蒸干 |
| B、进行蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C、进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
体积均为200mL浓度均为1mol/L的稀盐酸和氢氧化钠溶液中分别加入相同质量的铝,充分反应后生成气体在相同条件下的体积比为2:3.则下列说法正确的是( )
| A、盐酸过量,氢氧化钠不足 |
| B、氢氧化钠过量,盐酸不足 |
| C、两容器中投入的铝的质量为2.7g |
| D、条件不足,无法判断 |
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| B、2.8g乙烯中含有共价键的数目为0.5NA |
| C、标准状况下,11.2L苯中含有分子的数目为0.5NA |
| D、在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
下列对生铁和钢的各项叙述中,不正确的是( )
| A、生铁和钢都是铁的合金 |
| B、生铁的含碳量一定比钢高 |
| C、生铁的韧性优于钢,所以生铁有着比钢更广泛的用途 |
| D、生铁和钢都不是纯铁 |
下列关于晶体的说法一定正确的是( )
| A、分子晶体中都存在共价键 |
| B、金属晶体的熔点都比分子晶体的熔点高 |
| C、SiO2晶体中每个硅原子与两个氧原子以共价键相结合 |
D、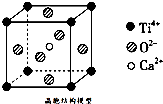 某物质晶胞结构如图,该物质的化学式为CaTiO3(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点) |
短周期元素R的最高价氧化物对应的水化物的化学式为HxROy,其气态氢化物的化学式为HzR(或RHz),已知1mol HxROy比1mol HzR的质量多64克,下列说法不正确的是( )
| A、有多种元素符合本题条件 |
| B、符合本题的HxROy有一元酸和多元酸 |
| C、z与x的数值相等 |
| D、R可能是第二周期元素 |