题目内容
某化学小组模拟工业生产制取HNO3,设计如图所示装置,其中a为一个可持续鼓入空气的橡皮球.
请回答下列问题:
(1)写出装置A中主要反应的化学方程式
(2)已知1molNO2与液态水反应生成HNO3溶液和NO气体放出热量46kJ,写出该反应的热化学方程式
该反应是一个可逆反应,欲要提高NO2的转化率,可采取的措施是
A.降低温度 B.升高温度 C.减小压强 D.增大压强
(3)实验结束后,关闭止水夹b、c,将装置D,浸入冰水中,现象是

请回答下列问题:
(1)写出装置A中主要反应的化学方程式
2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O
| ||
2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O
.
| ||
(2)已知1molNO2与液态水反应生成HNO3溶液和NO气体放出热量46kJ,写出该反应的热化学方程式
3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138kJ?mol-1
3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138kJ?mol-1
;该反应是一个可逆反应,欲要提高NO2的转化率,可采取的措施是
BC
BC
A.降低温度 B.升高温度 C.减小压强 D.增大压强
(3)实验结束后,关闭止水夹b、c,将装置D,浸入冰水中,现象是
颜色变浅
颜色变浅
.分析:(1)根据实验装置图,A装置是实验室制取氨气的装置,氯化铵与氢氧化钙在加热条件下发生反应生成氯化钙、氨气与水;
(2)1molNO2与液态水反应生成HNO3溶液和NO气体放出热量45.5kJ,书写热化学方程式注意标注物质聚集状态、配平化学方程式、给定条件下反应的焓变;
欲提高NO2的转化率,使平衡向右移动即可;
(3)实验结束后,关闭止水夹b、c,将装置D浸入冰水中,根据实验装置可知D装置中收集的是干燥的二氧化氮气体,存在平衡 2NO2?N2O4,正向是放热反应,二氧化氮气体是红棕色,四氧化二氮是无色气体,所以放入冰中温度降低,平衡右移,混合气体颜色变浅.
(2)1molNO2与液态水反应生成HNO3溶液和NO气体放出热量45.5kJ,书写热化学方程式注意标注物质聚集状态、配平化学方程式、给定条件下反应的焓变;
欲提高NO2的转化率,使平衡向右移动即可;
(3)实验结束后,关闭止水夹b、c,将装置D浸入冰水中,根据实验装置可知D装置中收集的是干燥的二氧化氮气体,存在平衡 2NO2?N2O4,正向是放热反应,二氧化氮气体是红棕色,四氧化二氮是无色气体,所以放入冰中温度降低,平衡右移,混合气体颜色变浅.
解答:解:(1)装置为实验室制氨气的实验装置,目的是制取氨气,化学方程式为:2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O,
故答案为:2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O;
(2)1molNO2与液态水反应生成HNO3溶液和NO气体放出热量46kJ,热化学方程式为3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138kJ?mol-1,
因反应是放热反应,所以降低温度平衡右移,二氧化氮转化率提高;正反应是气体体积减小的反应,所以增大压强平衡右移,二氧化氮转化率提高,故AD错误,BC正确,
故答案为:3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138kJ?mol-1;BC;
(3)制得的二氧化氮气体会转化为四氧化二氮,存在化学平衡 2NO2?N2O4,正向是放热反应,二氧化氮气体是红棕色,四氧化二氮是无色气体,所以放入冰中温度降低,平衡右移,混合气体颜色变浅;
故答案为:颜色变浅.
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(2)1molNO2与液态水反应生成HNO3溶液和NO气体放出热量46kJ,热化学方程式为3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138kJ?mol-1,
因反应是放热反应,所以降低温度平衡右移,二氧化氮转化率提高;正反应是气体体积减小的反应,所以增大压强平衡右移,二氧化氮转化率提高,故AD错误,BC正确,
故答案为:3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138kJ?mol-1;BC;
(3)制得的二氧化氮气体会转化为四氧化二氮,存在化学平衡 2NO2?N2O4,正向是放热反应,二氧化氮气体是红棕色,四氧化二氮是无色气体,所以放入冰中温度降低,平衡右移,混合气体颜色变浅;
故答案为:颜色变浅.
点评:本题考查了化学实验,涉及氨气的实验室制备、热化学方程式书写、影响化学平衡的因素、氮氧化物性质等,难度中等,注意对基础知识的理解掌握.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
(15分)某校兴趣小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
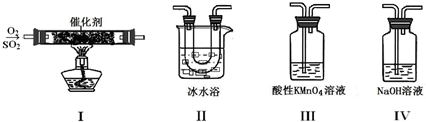
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO3 -10℃,SO3 44.8℃)
①装置I模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按I、II、III、IV的顺序连接装置,装置II的作用是 ;装置III中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是 。
③乙同学按I、II、IV的顺序连接装置,若装置IV中有40 mL 2.5 mol?L-1 NaOH溶液,反应后增重4.8 g,则装置IV中发生反应的总化学方程式是 。
某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)

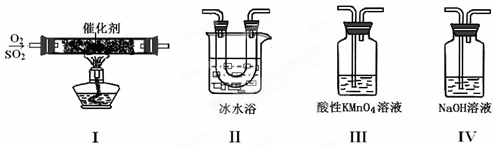
①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是 。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40 mL 2.5mol/L NaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生反应的化学方程式是 。
某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示的3组,第2组中物质X的化学式是 。
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(熔点:SO2-76.1℃,SO3 16.8℃;沸点:SO2-10℃,SO3 45℃)
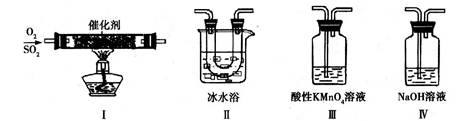
①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;
装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是
。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有70mL 2mol·L-1NaOH溶液,反应后增重5.12g,则装置Ⅳ中发生反应的化学方程式是 。
某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示的3组,第2组中物质X的化学式是 。
|
第1组 |
第2组 |
第3组 |
|
S(单质) |
SO2、X、Na2SO3、NaHSO3 |
SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2-76.1℃,SO3 16.8℃;沸点:SO2-10℃,SO3 45℃)
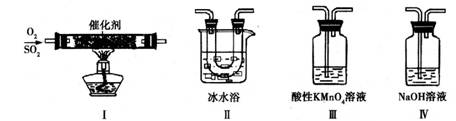
①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;
装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是
。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有70mL 2mol·L-1NaOH溶液,反应后增重5.12g,则装置Ⅳ中发生反应的化学方程式是 。