题目内容
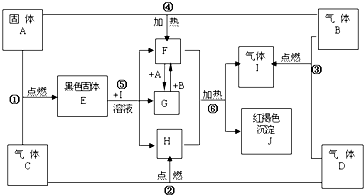
物质A、B、C、D、E、F、G、H、I、J、K有下图转化关系,其中气体D、E为单质,
请按要求回答下列问题.
(1)组成金属A的元素在周期表的位置是______,D的化学式是______
(2)写出反应“C→F”的离子方程式______;
(3)写出反应“I→J”的离子方程式______;
(4)写出金属 H与水蒸气在高温下反应的化学方程式______.
解:K为红褐色沉淀,则应为Fe(OH)3,则溶液J中含有Fe3+,气体E是黄绿色气体判断为Cl2,D应为H2,E应为氧化性气体Cl2,B应为HCl,则I为FeCl2,J为FeCl3,白色沉淀F能溶于过量NaOH溶液,则F为Al(OH)3,G为NaAlO2,A为Al,C为AlCl3,
(1)由以上分析可知A为Al,原子核外有3个电子层,最外层电子数为3,则位于周期表第3周期ⅢA族,D为H2,
故答案为:第3周期ⅢA族;H2;
(2)C→F是AlCl3氨水反应生成氢氧化铝和氯化铵,反应的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(3)反应“I→J”是FeCl2和Cl2发生反应生成氯化亚铁,反应离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)H为Fe,与水蒸气在高温下反应的化学方程式为3Fe+4H2O(g) Fe3O4+4H2,
Fe3O4+4H2,
故答案为:3Fe+4H2O(g) Fe3O4+4H2.
Fe3O4+4H2.
分析:K为红褐色沉淀,则应为Fe(OH)3,则溶液J中含有Fe3+,气体E是黄绿色气体判断为Cl2,D应为H2,E应为氧化性气体Cl2,B应为HCl,则I为FeCl2,J为FeCl3,白色沉淀F能溶于过量NaOH溶液,则F为Al(OH)3,G为NaAlO2,A为Al,C为AlCl3,根据物质的性质判断所发生的反应以及题目要求可解答该题.
点评:本题考查了物质转化关系的分析,物质性质的应用判断,涉及铁及其化合物,铝及其化合物发生反应的现象和产物的判断,题目难度中等.
(1)由以上分析可知A为Al,原子核外有3个电子层,最外层电子数为3,则位于周期表第3周期ⅢA族,D为H2,
故答案为:第3周期ⅢA族;H2;
(2)C→F是AlCl3氨水反应生成氢氧化铝和氯化铵,反应的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(3)反应“I→J”是FeCl2和Cl2发生反应生成氯化亚铁,反应离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)H为Fe,与水蒸气在高温下反应的化学方程式为3Fe+4H2O(g)
 Fe3O4+4H2,
Fe3O4+4H2,故答案为:3Fe+4H2O(g)
 Fe3O4+4H2.
Fe3O4+4H2.分析:K为红褐色沉淀,则应为Fe(OH)3,则溶液J中含有Fe3+,气体E是黄绿色气体判断为Cl2,D应为H2,E应为氧化性气体Cl2,B应为HCl,则I为FeCl2,J为FeCl3,白色沉淀F能溶于过量NaOH溶液,则F为Al(OH)3,G为NaAlO2,A为Al,C为AlCl3,根据物质的性质判断所发生的反应以及题目要求可解答该题.
点评:本题考查了物质转化关系的分析,物质性质的应用判断,涉及铁及其化合物,铝及其化合物发生反应的现象和产物的判断,题目难度中等.

练习册系列答案
相关题目