题目内容
【题目】草酸亚铁(FeC2O4)作为一种化工原料,可广泛用于新型电池材料、感光材料的生产。以炼钢厂的脱硫渣(主要成分是Fe2O3)为原料生产电池级草酸亚铁晶体的工艺流程如下:

(1)如图是反应温度、加料时间及分散剂的质量分数对草酸亚铁纯度的影响:
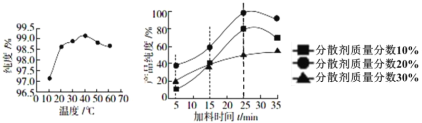
从图象可知,制备电池级草酸亚铁晶体的最佳实验条件是_____________________________
(2)写出“还原”过程中既是化合反应又是氧化还原反应的离子方程式______________________
(3)滤渣2中含有TiOSO4,进行热水解可以生成不溶于水的TiO2·H2O,该反应的化学方程式为___________________________。
(4)流程图中“滤液”经处理后得到一种化肥,其化学式为_________。“一系列操作”指___________。
(5)草酸亚铁固体纯度的测定
①准确称取m g草酸亚铁固体样品,溶于30 mL 2 mol·L-1H2SO4溶液中,在60~80℃水浴加热,用100 mL容量瓶配成100.00 mL溶液。
②取20.00 mL,用KMnO4标准溶液(浓度为c mol·L-1)消耗V1mL。
③向滴定后的溶液中加入适量锌粉,用试剂x检验Fe3+至极微量,过滤,洗涤,洗涤液并入滤液中。
④继续用KMnO4标准溶液(浓度为c mol·L-1)滴定至终点,消耗V2mL。
在②中溶液中发生2MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O,还有另一氧化还原反应,写出其离子方程式_____________,步骤③中检验其中微量的Fe3+的试剂x名称是_________溶液,固体样品的纯度为_____________(用含c、V1、V2的式子表示)
【答案】温度40℃,加料时间25min,分散剂质量分数20% Fe + 2Fe3+ = 3Fe2+ TiOSO4 + 2H2O![]() TiO2·H2O↓ + H2SO4 (NH4)2SO4 洗涤干燥 MnO4-+5Fe2++8H+= Mn2++5Fe3++4H2O KSCN
TiO2·H2O↓ + H2SO4 (NH4)2SO4 洗涤干燥 MnO4-+5Fe2++8H+= Mn2++5Fe3++4H2O KSCN ![]()
【解析】
根据图中信息脱硫渣和硫酸反应主要生成硫酸铁,过滤,向滤液中加入足量铁粉,与硫酸铁反应,过滤,滤渣主要是过量铁粉和TiOSO4,再向滤液中加入氨水生成氢氧化亚铁和硫酸铵,滤液中主要是硫酸铵,向氢氧化亚铁中加入草酸和乙醇,过滤,经过一系列最终得到草酸亚铁晶体。
(1)根据图像信息可知40℃纯度最高,加料时间在25min产品纯度最高,分散剂质量分数20%时产品纯度最高,因此制备电池级草酸亚铁晶体的最佳实验条件是温度40℃,加料时间25min,分散剂质量分数20%;故答案为:温度40℃,加料时间25min,分散剂质量分数20%。
(2)写出“还原”过程中既是化合反应又是氧化还原反应的是铁和硫酸铁反应生成硫酸亚铁,其离子方程式Fe + 2Fe3+ = 3Fe2+;故答案为:Fe + 2Fe3+ = 3Fe2+。
(3)滤渣2中含有TiOSO4,进行热水解可以生成不溶于水的TiO2·H2O,该反应的化学方程式为TiOSO4 + 2H2O![]() TiO2·H2O↓+ H2SO4;故答案为:TiOSO4 + 2H2O
TiO2·H2O↓+ H2SO4;故答案为:TiOSO4 + 2H2O![]() TiO2·H2O↓ + H2SO4。
TiO2·H2O↓ + H2SO4。
(4)过量氨水和硫酸亚铁反应生成氢氧化亚铁和硫酸铵,因此流程图中“滤液”经处理后得到一种化肥,其化学式为(NH4)2SO4。 “一系列操作”指是过滤后需要洗涤干燥;故答案为:(NH4)2SO4;洗涤干燥。
(5)在②中溶液中发生2MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O,还有另一氧化还原反应是亚铁离子被酸性高锰酸根反应,其离子方程式MnO4-+5Fe2++8H+= Mn2++5Fe3++4H2O,步骤③用KSCN溶液检验其中微量的Fe3+,步骤④是亚铁离子消耗高锰酸钾V2 mL,根据MnO4- — 5Fe2+得到n(Fe2+)= 5c mol·L1×V2×103L =5c×V2×103mol,因此固体样品的纯度为![]() ;故答案为:MnO4-+5Fe2++8H+= Mn2++5Fe3++4H2O;KSCN;
;故答案为:MnO4-+5Fe2++8H+= Mn2++5Fe3++4H2O;KSCN;![]() 。
。

 名校课堂系列答案
名校课堂系列答案