题目内容
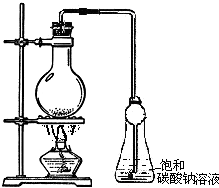 实验室用乙酸和乙醇在浓硫酸作用下反应制备乙酸乙酯,反应装置如右图:
实验室用乙酸和乙醇在浓硫酸作用下反应制备乙酸乙酯,反应装置如右图:已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH;②部分有机物的沸点如下:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.5 | 78.5 | 117.9 | 77 |
(1)写出制备乙酸乙酯的化学方程式
(2)浓硫酸的作用是
(3)用如图所示装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为
(4)实验所得到的乙酸乙酯中常含有一定量的乙醇、乙醚和水,先加入无水氯化钙后过滤,可除去
分析:(1)根据酯化反应原理,羧酸脱去羟基醇脱氢写出化学方程式:
(2)浓硫酸起到催化剂、吸水剂的作用;乙酸乙酯在饱和碳酸钠溶液中的溶解度降低,饱和碳酸钠溶液能够溶解乙醇和吸收乙酸;球形干燥管防止倒吸;
(3)产率很低的原因有:乙酸和乙醇容易挥发,温度过高浓硫酸能够和乙醇发生反应生成乙醚或者乙烯;
(4)用氯化钙除去少量水,依据乙酸乙酯沸点分析收集温度;
(2)浓硫酸起到催化剂、吸水剂的作用;乙酸乙酯在饱和碳酸钠溶液中的溶解度降低,饱和碳酸钠溶液能够溶解乙醇和吸收乙酸;球形干燥管防止倒吸;
(3)产率很低的原因有:乙酸和乙醇容易挥发,温度过高浓硫酸能够和乙醇发生反应生成乙醚或者乙烯;
(4)用氯化钙除去少量水,依据乙酸乙酯沸点分析收集温度;
解答:解:(1)由于酯化反应中,羧酸脱去的是羟基,故乙酸乙酯中的氧原子含有18O,反应方程式为CH3COOH+C2H5OH
CH3COOC2H5+H2O;
故答案为:CH3COOH+C2H5OH
CH3COOC2H5+H2O;
(2)由于反应剧烈,烧瓶中压强迅速减小,锥形瓶中的饱和碳酸钠溶液可能会被吸入发生装置,故用球形干燥管防止倒吸;在饱和碳酸钠溶液中,乙酸乙酯的溶解度较低,且能够溶解乙醇,反应掉乙酸;
故答案为:催化剂、吸水剂;降低乙酸乙酯的溶解度;防止倒吸;
(3)由于酯化反应是可逆的过程,没有及时蒸出乙酸乙酯,生成乙酸乙酯会减少;原料来不及反应就被蒸出、温度过高发生了副反应都能降低乙酸乙酯的产率,
故答案为:原料来不及反应就被蒸出;温度过高发生了副反应;
(4)实验所得到的乙酸乙酯中常含有一定量的乙醇、乙醚和水,先加入无水氯化钙后过滤,可除去水,在蒸馏收集77°C的馏分得到纯净的乙酸乙酯;
故答案为:水,77;
| 浓硫酸 |
| 加热 |
故答案为:CH3COOH+C2H5OH
| 浓硫酸 |
| 加热 |
(2)由于反应剧烈,烧瓶中压强迅速减小,锥形瓶中的饱和碳酸钠溶液可能会被吸入发生装置,故用球形干燥管防止倒吸;在饱和碳酸钠溶液中,乙酸乙酯的溶解度较低,且能够溶解乙醇,反应掉乙酸;
故答案为:催化剂、吸水剂;降低乙酸乙酯的溶解度;防止倒吸;
(3)由于酯化反应是可逆的过程,没有及时蒸出乙酸乙酯,生成乙酸乙酯会减少;原料来不及反应就被蒸出、温度过高发生了副反应都能降低乙酸乙酯的产率,
故答案为:原料来不及反应就被蒸出;温度过高发生了副反应;
(4)实验所得到的乙酸乙酯中常含有一定量的乙醇、乙醚和水,先加入无水氯化钙后过滤,可除去水,在蒸馏收集77°C的馏分得到纯净的乙酸乙酯;
故答案为:水,77;
点评:本题考查了乙酸乙酯制备反应原理和实验注意问题,物质分离方法的应用,乙酸乙酯除杂实验方案设计判断,题目难度中等.

练习册系列答案
相关题目