题目内容
(1)A、B、C三个烧杯中分别盛有相同浓度的稀硫酸.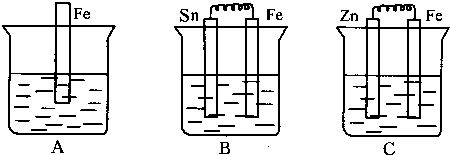
A中:Fe的反应属于化学腐蚀 (填“化学腐蚀”或“电化学腐蚀”).
B中:Sn极的电极反应式为 ;Sn极附近溶液的酸性 (填“增大”、“减小”或“不变”).
C中:被腐蚀的金属是 ,该电极反应式为
(2)某种氢氧燃料电池是用固体金属化物陶瓷作电解质,两极上发生的电极反应分别为:
A极:2H2+2O2--4e-═2H2O; B极:O2+4e-═2O2-
则A极是电池的 极;电子从该极 (填“流入”或“流出”)

A中:Fe的反应属于化学腐蚀
B中:Sn极的电极反应式为
C中:被腐蚀的金属是
(2)某种氢氧燃料电池是用固体金属化物陶瓷作电解质,两极上发生的电极反应分别为:
A极:2H2+2O2--4e-═2H2O; B极:O2+4e-═2O2-
则A极是电池的
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)由装置图可知A发生化学腐蚀,B、C为原电池装置,活泼金属为负极,发生氧化反应,以此解答该题;
(2)由电极方程式可知,燃料电池中A发生氧化反应,应为负极,B发生还原反应,为原电池的正极.
(2)由电极方程式可知,燃料电池中A发生氧化反应,应为负极,B发生还原反应,为原电池的正极.
解答:
解:(1)A中为铁与硫酸的反应,发生化学腐蚀;B为原电池装置,Fe比Sn活泼,Fe为负极,Sn为正极,正极方程式为2H++2e-=H2↑,反应消耗H+,Sn附近溶液的酸性减小,C为原电池装置,Zn比Fe活泼,被腐蚀的金属为Zn,电极方程式为Zn-2e-=Zn2+,
故答案为:化学腐蚀;2H++2e-=H2↑;减小;Zn-2e-=Zn2+;Zn;Zn-2e-=Zn2+;
(2)由电极方程式可知,燃料电池中A发生氧化反应,应为负极,B发生还原反应,为原电池的正极,电子从负极流出,流入正极,
故答案为:负;流出.
故答案为:化学腐蚀;2H++2e-=H2↑;减小;Zn-2e-=Zn2+;Zn;Zn-2e-=Zn2+;
(2)由电极方程式可知,燃料电池中A发生氧化反应,应为负极,B发生还原反应,为原电池的正极,电子从负极流出,流入正极,
故答案为:负;流出.
点评:本题考查金属的电化学腐蚀与防护,题目难度不大,注意金属的电化学腐蚀与化学腐蚀的区别,以及比较金属腐蚀快慢的方法.

练习册系列答案
相关题目
下列变化中,不需要破坏化学键的是( )
| A、碘加热升华 |
| B、氯酸钾加热分解 |
| C、SiO2加热溶化 |
| D、氯化钠溶于水 |
如果发现了原子序数为116的元素,下列对它的叙述中正确的是( )
①位于第7周期
②非金属元素
③最外电子层有6个电子
④没有放射性
⑤属于氧族元素
⑥属于锕系元素.
①位于第7周期
②非金属元素
③最外电子层有6个电子
④没有放射性
⑤属于氧族元素
⑥属于锕系元素.
| A、①③⑤ | B、②④⑥ |
| C、①③⑥ | D、③④⑤ |

 某同学为了探究不同条件下铁钉的锈蚀情况,设计了如下实验:
某同学为了探究不同条件下铁钉的锈蚀情况,设计了如下实验: