��Ŀ����
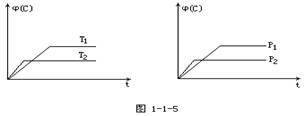
�ݻ���Ϊ1L�ļס����������������У��ֱ����2molA��2molB��1molA��1molB����ͬ�����£��������з�Ӧ��A(g)��B(g) xC(g�� ��H����0�������������c(A)��ʱ��t�ı仯��ͼ��ʾ������˵����ȷ����
xC(g�� ��H����0�������������c(A)��ʱ��t�ı仯��ͼ��ʾ������˵����ȷ����
A���÷�Ӧ��x=3
B���������£��÷�Ӧ��ƽ�ⳣ��K��4
C�������������¿����̷�Ӧ��ƽ���ʱ��Ҳ�����ƽ��ת����
D�������������䣬����������ٳ���0.2 mol C��ƽ��ʱA�������������
B
�������������A����ͼ���֪ƽ��ʱ��������ƽ��ʱ��A��ת����Ϊ ����������A��ת����Ϊ
����������A��ת����Ϊ ����������ѹǿ���������ڴ�����ѹǿƽ�ⲻ�ƶ�����Ӧǰ�������������䣬��x=1+1=2����A����B���¶���ͬ��ƽ�ⳣ����ȣ�����B��������ƽ�ⳣ������ͼ��֪A��Ũ�ȱ仯��=0.5mol��L��1����
����������ѹǿ���������ڴ�����ѹǿƽ�ⲻ�ƶ�����Ӧǰ�������������䣬��x=1+1=2����A����B���¶���ͬ��ƽ�ⳣ����ȣ�����B��������ƽ�ⳣ������ͼ��֪A��Ũ�ȱ仯��=0.5mol��L��1����
A��g��+B��g�� 2C��g��
2C��g��
��ʼ��mol��L��1����1 1 0
�仯��mol��L��1����0.5 0.5 1
�仯��mol��L��1����0.5 0.5 1
��ƽ�ⳣ��k= =4����B��ȷ�������¶ȣ���Ӧ���ʼӿ죬���̵���ƽ���ˮ�⣬ƽ�����淴Ӧ�����ƶ�����Ӧ���ת���ʽ��ͣ���C���������������䣬����������ٳ���0.2 mol C��ƽ��ʱA������������䣬D����
=4����B��ȷ�������¶ȣ���Ӧ���ʼӿ죬���̵���ƽ���ˮ�⣬ƽ�����淴Ӧ�����ƶ�����Ӧ���ת���ʽ��ͣ���C���������������䣬����������ٳ���0.2 mol C��ƽ��ʱA������������䣬D����
���㣺���黯ѧƽ��ͼ��ѧƽ���Ӱ����������㣬��ѧƽ�ⳣ���ȡ�

һ���¶�ʱ�����ݻ�Ϊ2L���ܱ������г���һ������SO2��O2��������Ӧ2SO2(g)+O2(g) 2SO3(g) ?H��?196kJ��moL?1��һ��ʱ����ƽ�⣬��Ӧ�����вⶨ�IJ������ݼ��±���
2SO3(g) ?H��?196kJ��moL?1��һ��ʱ����ƽ�⣬��Ӧ�����вⶨ�IJ������ݼ��±���
| ��Ӧʱ��/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | | 0.4 |
| 15 | 0.8 | |
A����Ӧ��ǰ5min��ƽ������Ϊv (SO2)=0.08mol��L?1 min?1
B�������¶Ȳ��䣬��ƽ�����������ٳ���1molSO2��0.5molO2ʱ��v (��)�� v (��)
C�����������������䣬����ʼʱ�������г���2molSO3����ƽ��ʱ����78.4kJ������
D����ͬ�¶��£���ʼʱ�������г���1.5mol SO3����ƽ��ʱSO3��ת����Ϊ40%
��1000Kʱ����֪��ӦNi��s����H2O��g�� NiO��s����H2��g����ƽ�ⳣ��K��0.0059����ˮ���������������ʵ���Ũ�����ʱ���˷�Ӧ
NiO��s����H2��g����ƽ�ⳣ��K��0.0059����ˮ���������������ʵ���Ũ�����ʱ���˷�Ӧ
| A���Ѵ�ƽ��״̬ | B��δ��ƽ��״̬����Ӧ������� |
| C��δ��ƽ��״̬����Ӧ������� | D����ȷ�� |
ij�¶��£����һ�����ܱ������н������·�Ӧ��2X��g��+Y��g�� Z��g��+W��s�� ��H��0������������ȷ����
Z��g��+W��s�� ��H��0������������ȷ����
| A���������м����������Ӧ���ʲ��� |
| B����������W���淴Ӧ�������� |
| C�������¶ȣ�����Ӧ���������淴Ӧ���ʼ�С |
| D�������������ѹ����������λ����ڻ���ӵİٷ�������Ч��ײ�������� |
��300��ʱ���ı���ʼ��Ӧ����n(H2)�Է�ӦN2(g) + 3H2(g)  2NH3(g)+Q��Q>0����Ӱ������ͼ��ʾ������˵����ȷ����
2NH3(g)+Q��Q>0����Ӱ������ͼ��ʾ������˵����ȷ����
| A����Ӧ��b��ﵽƽ�� |
| B��b��H2��ת������� |
| C��c��N2��ת������� |
| D��a��b��c�����ƽ�ⳣ��Kb > Ka > Kc |
��CO�ϳɼ״���CH3OH���Ļ�ѧ��Ӧ����ʽΪCO(g)+2H2(g) CH3OH(g) ��H��0
CH3OH(g) ��H��0
������ͬ�����ʵ���Ͷ�ϣ����CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����( )
| A��ƽ�ⳣ����K(a)��K(c) K(b)��K(d) |
| B������Ӧ���ʣ�v(a)��v(c) v(b)��v(d) |
| C��ƽ��Ħ��������M(a)��M(c) M(b)��M(d) |
| D��ƽ��ʱa��һ����n(CO)��n(H2)��1:2 |
��֪��(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) ��H="74.9" kJ��mol-1������˵������ȷ����
| A���÷�Ӧ���ر䡢�ʱ�Դ���0 |
| B���÷�Ӧ�����ȷ�Ӧ�����һ�������Է����� |
| C��̼���ηֽⷴӦ�������ӣ�����κ�����������̼���ηֽ�һ���Է����� |
| D�����Է����еķ�Ӧһ���Ƿ��ȷ�Ӧ�������Է����еķ�Ӧһ�������ȷ�Ӧ |
һ���¶��£���2L�ܱ������з������з�Ӧ��4NO2(g)+O2(g) 2N2O5(g)����֪�÷�Ӧ��ƽ�ⳣ����
2N2O5(g)����֪�÷�Ӧ��ƽ�ⳣ���� ��
�� ������ϵ��
������ϵ�� ����λ��mol����ʱ��仯���±���
����λ��mol����ʱ��仯���±���
| ʱ��(s) | 0 | 500 | 1000 | 1500 |
| t1�� | 20 | 13.96 | 10.08 | 10.08 |
| t2�� | 20 | a | b | c |
����˵��һ����ȷ���ǣ� ��
A������ӦΪ���ȷ�Ӧ
B�����t2�棼t1�棬��ô a��b=c����a=10+0.5b
C�����t2�棼t1�棬��ôt2��ﵽƽ���ʱ�����1000s��1500s֮��
D�����t2�棾t1�棬��ôb��10.08
 eC(��)+fD(��)����Ӧ�����б��������������䣬C�������
eC(��)+fD(��)����Ӧ�����б��������������䣬C�������