题目内容
Mn2+、Bi3+、BiO3-、MnO4-、H+、H2O组成的一个氧化还原系统中,发生BiO3---Bi3+的反应过程,据此回答下列问题
(1)该氧化还原反应中,被氧化的元素是
(2)将以上物质分别填入下面对应的横线上,组成一个未配平的化学方程式.
(3)请将氧化剂、还原剂的化学式及配平后的系数填入下列相应的位置中,并用单线桥法标出电子转移的方向和数目.
□-----+□------.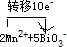
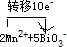 .
.
(1)该氧化还原反应中,被氧化的元素是
Mn
Mn
,氧化剂是BiO3-
BiO3-
;(2)将以上物质分别填入下面对应的横线上,组成一个未配平的化学方程式.
Mn2+
Mn2+
+BiO3-
BiO3-
+H+
H+
→MnO4-
MnO4-
+Bi3+
Bi3+
+H2O(3)请将氧化剂、还原剂的化学式及配平后的系数填入下列相应的位置中,并用单线桥法标出电子转移的方向和数目.
□-----+□------.
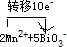
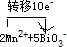
分析:发生BiO3-→Bi3+的反应,Bi元素由+5价降低为+3价,则还发生Mn2+→MnO4-,Mn元素由+2升高为+7,发生Mn2++BiO3-+H+→MnO4-+Bi3++H2O,结合电子守恒及质量守恒定律来配平,利用化合价的变化来解答单线桥法标出电子转移的方向和数目.
解答:解:发生BiO3---Bi3+的反应,Bi元素由+5价降低为+3价,则还发生Mn2+→MnO4-,Mn元素由+2升高为+7,发生Mn2++BiO3-+H+→MnO4-+Bi3++H2O,
(1)Mn元素的化合价升高,则被氧化,Bi元素的化合价降低,则BiO3-为氧化剂,故答案为:Mn;BiO3-;
(2)发生Mn2++BiO3-+H+→MnO4-+Bi3++H2O,由电子守恒及质量守恒定律可知,该反应为2Mn2++5BiO3-+14H+═2MnO4-+5Bi3++7H2O,
故答案为:Mn2+;BiO3-;H+;MnO4-;Bi3+;
(3)BiO3-为氧化剂,Mn2+为还原剂,反应2Mn2++5BiO3-+14H+═2MnO4-+5Bi3++7H2O中,Mn失去2×5e-,反应中转移10e-,所以单线桥法标电子转移的方向和数目为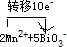 ,
,
故答案为: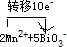 .
.
(1)Mn元素的化合价升高,则被氧化,Bi元素的化合价降低,则BiO3-为氧化剂,故答案为:Mn;BiO3-;
(2)发生Mn2++BiO3-+H+→MnO4-+Bi3++H2O,由电子守恒及质量守恒定律可知,该反应为2Mn2++5BiO3-+14H+═2MnO4-+5Bi3++7H2O,
故答案为:Mn2+;BiO3-;H+;MnO4-;Bi3+;
(3)BiO3-为氧化剂,Mn2+为还原剂,反应2Mn2++5BiO3-+14H+═2MnO4-+5Bi3++7H2O中,Mn失去2×5e-,反应中转移10e-,所以单线桥法标电子转移的方向和数目为
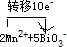 ,
,故答案为:
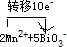 .
.点评:本题考查氧化还原反应,明确反应中元素的化合价变化即可解答,题目难度不大,确定还原剂发生的反应是解答的关键.

练习册系列答案
相关题目