��Ŀ����
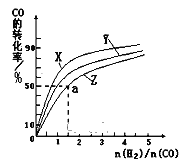
����Ŀ���л���A�����µ�ת����ϵ��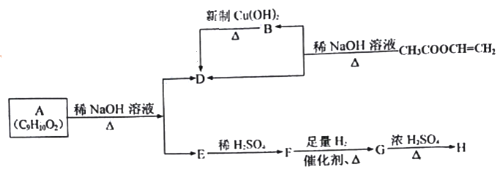
��֪��![]() ���ǻ���˫��̼ԭ��������ʱ����������ת����
���ǻ���˫��̼ԭ��������ʱ����������ת����
![]()
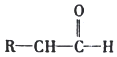
![]() ����
����![]() ��Һ������ɫ��Ӧ��
��Һ������ɫ��Ӧ��
![]() �ķ�Ӧ�У��л�����ֻ��һ�ֽṹ����ʹ��ˮ��ɫ��
�ķ�Ӧ�У��л�����ֻ��һ�ֽṹ����ʹ��ˮ��ɫ��
��ش��������⣺
![]() �Ľṹ��ʽΪ______��
�Ľṹ��ʽΪ______��![]() �к��еĹ���������Ϊ______��
�к��еĹ���������Ϊ______��
![]() �Ļ�ѧ����ʽΪ______��
�Ļ�ѧ����ʽΪ______��![]() �Ļ�ѧ����ʽΪ______��
�Ļ�ѧ����ʽΪ______��
![]() �����ϳɹ�����û���漰�ķ�Ӧ������______
�����ϳɹ�����û���漰�ķ�Ӧ������______![]() ����ĸ
����ĸ![]() ��
��
![]() ȡ����Ӧ
ȡ����Ӧ ![]() ������Ӧ
������Ӧ ![]() �ӳɷ�Ӧ
�ӳɷ�Ӧ ![]() ��ȥ��Ӧ
��ȥ��Ӧ ![]() ������Ӧ
������Ӧ ![]() ��ԭ��Ӧ
��ԭ��Ӧ
![]() ������______����F��ͬ���Һ�������ͬ���칹��Ľṹ��ʽΪ______��
������______����F��ͬ���Һ�������ͬ���칹��Ľṹ��ʽΪ______��
���𰸡�![]() ������̼̼˫��
������̼̼˫�� ![]()
![]() +H2O b �Լ�����
+H2O b �Լ����� ![]()
��������
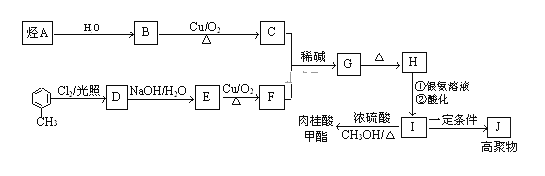
��������Ϣ��֪��������ϩ������������ˮ�⣬���ɴ����ƺ���ȩ����DΪ�����ơ�BΪ��ȩ��A�ڼ���������ˮ������D��E��E���ữ�õ�F��F����![]() ��Һ������ɫ��Ӧ��F����ȫ�⻯�õ�G��
��Һ������ɫ��Ӧ��F����ȫ�⻯�õ�G��![]() �ķ�Ӧ�У��л�����ֻ��һ�ֽṹ����ʹ��ˮ��ɫ����÷�ӦΪ��ȥ��Ӧ����GΪ
�ķ�Ӧ�У��л�����ֻ��һ�ֽṹ����ʹ��ˮ��ɫ����÷�ӦΪ��ȥ��Ӧ����GΪ![]() ����Щ�ƶ�AΪ
����Щ�ƶ�AΪ![]() ��FΪ
��FΪ![]() ��GΪ
��GΪ![]() ��
��
![]() �Ľṹ��ʽΪ
�Ľṹ��ʽΪ![]() ��
��![]() �к��еĹ���������Ϊ��������̼̼˫����
�к��еĹ���������Ϊ��������̼̼˫����
![]() �Ļ�ѧ����ʽΪ��
�Ļ�ѧ����ʽΪ��![]() ��
��![]() �Ļ�ѧ����ʽΪ��
�Ļ�ѧ����ʽΪ��![]() +H2O��
+H2O��
![]() ����ˮ������ȡ����Ӧ����ȩ��������ͭ�ķ�Ӧ����������Ӧ��
����ˮ������ȡ����Ӧ����ȩ��������ͭ�ķ�Ӧ����������Ӧ��![]() ת��Ϊ
ת��Ϊ![]() ���ڼӳɷ�Ӧ��Ҳ���ڻ�ԭ��Ӧ��
���ڼӳɷ�Ӧ��Ҳ���ڻ�ԭ��Ӧ��![]() ת��Ϊ
ת��Ϊ![]() ������ȥ��Ӧ������ת������û���漰������Ӧ����ѡ��b��
������ȥ��Ӧ������ת������û���漰������Ӧ����ѡ��b��
![]() Ϊ
Ϊ![]() ��F�����ƣ��Լ����ӣ���F��ͬ���Һ�������ͬ���칹��Ľṹ��ʽΪ��
��F�����ƣ��Լ����ӣ���F��ͬ���Һ�������ͬ���칹��Ľṹ��ʽΪ�� ��
��

����Ŀ����100��ʱ����0.40 mol���������������һ��2 L��յ��ܱ������У�������Ӧ��2NO2 N2O4��ÿ��һ��ʱ��ͶԸ������ڵ����ʽ��з������õ��±����ݣ�
ʱ��/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
��1�������������£��ӷ�Ӧ��ʼ��20 sʱ����NO2��ʾ��ƽ����Ӧ����Ϊ__________mol��L1��s1��
��2��n3________(����>����<������=��)n4���÷�Ӧ��ƽ�ⳣ��K����ֵΪ___________(��ȷ��0.1)��
��3��������ͬ�����������������г���N2O4��Ҫ�ﵽ����ƽ��״̬��N2O4����ʼŨ����______mol��L1��
��4��������3���ﵽƽ���N2O4��ת����Ϊ______________����������ƽ��Ħ������Ϊ______________��
��5���ﵽƽ�����������¶ȣ�������ɫ�����������¶Ⱥ�Ӧ2NO2N2O4��ƽ�ⳣ����_______________(��������������С������������)��
��6���ﵽƽ����������ܱ��������ٳ���0.32 mol He�����������������Ϊ4 L����ƽ�⽫______________�����������ƶ����������ƶ����������ƶ�������
����Ŀ��NO��NO2������β������Ҫ�ĺ���������ش��������⣺
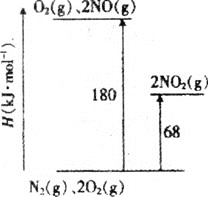
��1����֪��������ת�������е������仯��ͼ(ͼ�б�ʾ����2molNO2�������仯)��1molNO����ΪNO2���ʱ���H=___��
��2��ij�¶��£���Ӧ��ƽ�ⳣ�����£�
a.2NO2(g)N2(g)+2O2(g) K=6.7��1016
b.2NO(g)N2(g)+O2(g) K=2.2��1030
�ֽⷴӦ���ƽϴ�ķ�Ӧ��___(����a������b��)����Ӧ2NO(g)+O2(g)2NO2(g)��K=___(������λ��Ч����)��
��3����֪��Ӧ2NO(g)+O2(g)2NO2������Ӧ����v��=k1cm(NO)cn(O2)������kΪ���ʳ�������ͨ������ʵ�����ݼ���k��m��n��
��ʼŨ��/molL-1 | |||
��� | NO | O2 | ��ʼ���� /molL-1s-1 |
1 | 0.02 | 0.0125 | 7.98��10-3 |
2 | 0.02 | 0.0250 | 15.96��10-3 |
3 | 0.04 | 0 0125 | 31.92��10-3 |
��k1=___��m=___��n=___��
��4����֪�÷�Ӧ������Ϊ��
��һ����NO+NO![]() N2O2 ����ƽ��
N2O2 ����ƽ��
�ڶ�����N2O2+O2![]() 2NO2 ����Ӧ
2NO2 ����Ӧ
���пɽ�����Ϊ�ڶ�����Ӧ��Ӱ���һ����ƽ�⣬��һ����Ӧ�У�v(��)=k1c2(NO)��v(��)=k-1c(N2O2)������������ȷ����___(����ĸ)��
A.��һ����Ӧ��ƽ�ⳣ��K=![]()
B.v(��һ��������Ӧ)<v(��һ���ķ�Ӧ)
C.�ڶ����Ļ�ܱȵ�һ���Ļ�ܸ�
D.�ڶ�����N2O2��O2����ײ100����Ч
��5��һ�������²��������NO��O2��NO2Ũ�ȷ�����ͼ�仯��
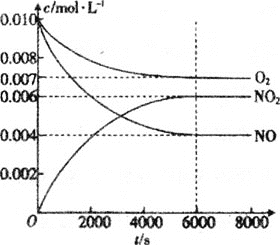
��NO��ƽ��ת����Ϊ___��
�ڸ��¶��·�Ӧ2NO(g)+O2(g)2NO2(g)��ƽ�ⳣ��Ϊ___(��������)��