题目内容
 某温度(t℃)下的溶液中,c(H+)=10-xmol?L-1,c(OH-)=10-y mol?L-1,x与y的关系如图所示:
某温度(t℃)下的溶液中,c(H+)=10-xmol?L-1,c(OH-)=10-y mol?L-1,x与y的关系如图所示:请回答下列问题:
(1)此温度时,水的离子积常数KW为
10-13 mol2?L-2
10-13 mol2?L-2
,则该温度t>
>
25℃(填“>”、“<”或“=”).(2)若将此温度(t℃)下,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(假设混合后溶液体积的微小变化忽略不计),试通过计算以下不同情况时两种溶液的体积比.
①若所得混合液为中性,则a:b是多少?
②若所得混合液的pH=2,则a:b是多少?
分析:(1)由图象可知,x=0时,y=13,y=0时,x=13,则有x+y=13,根据KW=c(H+)×c(OH-)计算;
(2)若将此温度(t℃)下,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合,此时NaOH溶液中c(OH-)=
mol/L=0.01mol/L,稀硫酸溶液中c(H+)=0.1mol/L,
根据反应后溶液的酸碱性判断反应的程度,以此计算.
(2)若将此温度(t℃)下,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合,此时NaOH溶液中c(OH-)=
| 10-13 |
| 10-11 |
根据反应后溶液的酸碱性判断反应的程度,以此计算.
解答:解:(1)由图象可知,x=0时,y=13,y=0时,x=13,则有x+y=13,则KW=c(H+)×c(OH-)=(10-xmol?L-1)×(10-y mol?L-1)=10-13 mol2?L-2>10-14 mol2?L-2,
则温度高于常温,
故答案为:10-13 mol2?L-2;>;
(2)若将此温度(t℃)下,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合,此时NaOH溶液中c(OH-)=
mol/L=0.01mol/L,
稀硫酸溶液中c(H+)=0.1mol/L,则
①若所得混合液为中性,则有0.01a=0.1b,a:b=10:1,
答:a:b是10:1;
②若所得混合液的pH=2,则有
=0.01,a:b=9:2,
答:a:b是9:2.
则温度高于常温,
故答案为:10-13 mol2?L-2;>;
(2)若将此温度(t℃)下,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合,此时NaOH溶液中c(OH-)=
| 10-13 |
| 10-11 |
稀硫酸溶液中c(H+)=0.1mol/L,则
①若所得混合液为中性,则有0.01a=0.1b,a:b=10:1,
答:a:b是10:1;
②若所得混合液的pH=2,则有
| 0.1b-0.01a |
| a+b |
答:a:b是9:2.
点评:本题考查酸碱混合的定性判断,题目难度中等,注意水的离子积常数的计算,把握相关计算公式的运用.

练习册系列答案
相关题目
|
(1)合成氨反应的机理为
① ;
![]()
![]()
![]() ②N2 N2吸 2N 2N吸
②N2 N2吸 2N 2N吸
③ ;
![]() ④NH吸+H吸 NH2吸;
④NH吸+H吸 NH2吸;
![]()
![]() ⑤NH2吸+H吸 NH3吸 NH3。
⑤NH2吸+H吸 NH3吸 NH3。
(2)T=673K时,合成氨反应的热化学方程为 。
(3)液氨与水颇为相像,它能溶解多种无机及有机分子,其电离方程式可表示为:
![]() 2NH3 NH+4+NH-2(某温度http://today..com下其离子积常数为10-30)。液氨中的pNH4与水中的pH类似,则该温度http://today..com下液氨的pNH4= 。
2NH3 NH+4+NH-2(某温度http://today..com下其离子积常数为10-30)。液氨中的pNH4与水中的pH类似,则该温度http://today..com下液氨的pNH4= 。
(4)盐酸肼(N2H4Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式 。
(5)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,N2H4在氧气中完全燃烧生成氮气,肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时:
负极的电极反应式是 。
 (2013?上饶一模)“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题
(2013?上饶一模)“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题 (1)合成氨反应的机理为
(1)合成氨反应的机理为 H2吸
H2吸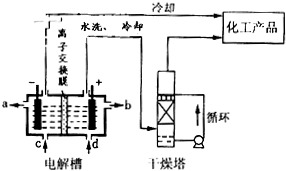
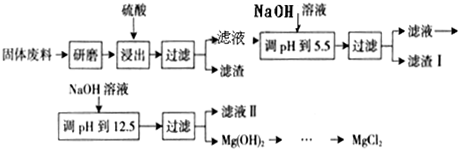
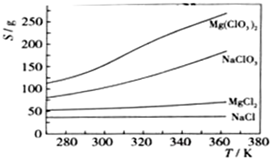
 铜是人类最早使用的金属,被广泛应用于电气、轻工、机械制造和国防工业等.已知Cu2O与H2SO4能发生反应:Cu2O+H2SO4=Cu+CuSO4+H2O.
铜是人类最早使用的金属,被广泛应用于电气、轻工、机械制造和国防工业等.已知Cu2O与H2SO4能发生反应:Cu2O+H2SO4=Cu+CuSO4+H2O.