题目内容
下列说法或表示方法正确的是( )A.等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多
B.氢气的燃烧热为285.8 kJ·mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)![]() 2H2O(l) ΔH=-285.8 kJ·mol-1
2H2O(l) ΔH=-285.8 kJ·mol-1
C.Ca(OH)2(s)+NH4HCO3(s)![]() CaCO3(s)+NH3(g)+2H2O(l) ΔH<0
CaCO3(s)+NH3(g)+2H2O(l) ΔH<0
D.已知中和热为57.2 kJ·mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量要大于57.2 kJ
D
解析:对于A,产物都是SO2,而硫磺固体变为蒸气时要吸收热量,A项不正确;在101 kPa压强下,1 mol物质完全燃烧时的热效应叫做该物质的标准燃烧热,B中为2 mol 的H2燃烧,故放出的热量应为2×285.8 kJ·mol-1,B项不正确;C反应是一个吸热反应,ΔH>0,C项也不正确;浓硫酸在稀释过程中放热,故D项正确。

练习册系列答案
相关题目
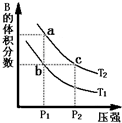 对于反应A(g)?2B(g)△H>0,在温度为T1、T2时,平衡体系中B的体积分数随压强变化的曲线如图所示.回答下列各题.
对于反应A(g)?2B(g)△H>0,在温度为T1、T2时,平衡体系中B的体积分数随压强变化的曲线如图所示.回答下列各题.

