题目内容
1.写出铁与盐酸反应的化学方程式和离子方程式:化学方程式:Fe+2HCl=FeCl2+H2↑
离子方程式:Fe+2H+=Fe2++H2↑.
分析 铁与盐酸反应生成氯化亚铁和氢气,氯化氢、氯化亚铁为强电解质,完全拆成离子形式,据此解答.
解答 解:铁与盐酸反应生成氯化亚铁和氢气,化学方程式:Fe+2HCl=FeCl2+H2↑;
离子方程式:Fe+2H+=Fe2++H2↑;
故答案为:Fe+2HCl=FeCl2+H2↑;Fe+2H+=Fe2++H2↑.
点评 本题考查了化学方程式、离子方程式的书写,明确反应实质是解题关键,题目简单.

练习册系列答案
相关题目
11.工业制硫酸中,下列关于沸腾炉出来的气体主要成分描述中,最合理是( )
| A. | SO2、O2、N2 | B. | SO2、O2、N2、矿尘 | C. | SO2、SO3 | D. | Cl2、Ar、N2 |
12.下列叙述正确的是( )
| A. | 分子式为C4H8的有机物可能存在4个C-C单键 | |
| B. |  、 、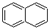 和 和 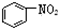 均属于芳香烃 均属于芳香烃 | |
| C. | 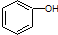 和 和 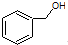 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 | |
| D. | 结构简式为C2H5-OH的核磁共振氢谱上有2个吸收峰 |
9.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质.以下叙述正确的是( )
| A. | 植物油不能使溴的四氯化碳溶液褪色 | |
| B. | 蔗糖水解的最终产物是葡萄糖 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 蛋白质能发生水解最终生成氨基酸 |
16.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1的NH4Cl溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)>c(Cl-) | |
| C. | 已知Ka(HF)=7.2×10-4,Ka(HCN)=6.2×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者 | |
| D. | 浓度均为0.1 mol•L-1的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:①>②>③ |
6.下列原子结构示意图正确的是( )
| A. |  | B. |  | C. |  | D. |  |
13.化学与环境、生活、材料密切相关.下列说法正确的是( )
| A. | 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 | |
| B. | 二氧化氯和三氯化铁都常用于自来水的处理,二者的作用原理是不相同的 | |
| C. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | 乙醇、糖类和蛋白质都是人体必需的营养物质 |
10.下列相关的叙述正确的是( )
| A. | 卤素离子(X-)只有还原性而无氧化性 | |
| B. | 某元素由化合态变成游离态,该元素一定被氧化 | |
| C. | 失电子难的原子获得电子的能力一定强 | |
| D. | 卤素最高价氧化物的分子式都为X2O7 |