题目内容
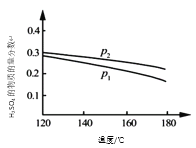
【题目】下图所示是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液。已知放电时电池反应为Pb+PbO2+4H++2![]() =2PbSO4+2H2O,下列有关说法正确的是( )
=2PbSO4+2H2O,下列有关说法正确的是( )

A.K与N相接时,能量由电能转化为化学能
B.K与N相接时,H+向Pb电极区迁移
C.K与M相接时,所用电源的a极为正极
D.K与M相接时,阳极附近的pH逐渐减小
【答案】D
【解析】
K与N相接时,为原电池反应,放电时,铅失电子发生氧化反应而作负极,电极反应式为Pb-2e-+SO42-=PbSO4,二氧化铅得电子作正极,电极反应式为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,电解质溶液中阳离子向正极移动,阴离子向负极移动,K与M连接时,为电解池装置,电解池中的Pb为阴极连接电源的负极,阳极是PbO2,结合电极方程式解答该题.
A.K与N相接时是原电池,Pb做负极,PbO2做正极,能量变化为化学能转化为电能,故A错误;
B.K与N相接时是原电池,Pb做负极,PbO2做正极,氢离子移向正极,故B错误;
C.K与M连接时,装置是电解池,电解池中的Pb为阴极连接电源的负极,故C错误;
D.K与M连接时,装置是电解池,阳极是PbO2,电解方程式为PbSO4+2H2O-2e-=PbO2+SO42-+4H+,阳极附近的pH逐渐减小,故D正确;
故选:D。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】已知:N2(g)+3H2(g)![]() 2NH3(l)△H=﹣132kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
2NH3(l)△H=﹣132kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
H2(g) | N2(g) | NH3(g) | |
1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
一定条件下,在体积1L的密闭容器中加入1molN2(g)和3molH2(g)充分反应,生成NH3(g)放出热量QkJ,下列说法正确的是

A.上图可表示合成氨过程中的能量变化
B.a的数值为1173
C.Q的数值为92
D.其它条件相同,反应使用催化剂时释放出的能量大于无催化剂时释放出的能量
【题目】在一定温度(T)时,X2(g)和H2反应生成HX的平衡常数如下表。
化学方程式 | K(T) |
F2+H2 | 1.8×1036 |
Cl2+H2 | 9.7×1022 |
Br2+H2 | 5.6×107 |
I2+H2 | 43 |
(1)I 有多种同位素,![]() 的中子数为______。
的中子数为______。
(2)用电子式表示HCl的形成过程______。
(3)下列说法正确的是______。
a 共价键的极性:HF>HCl
b 氯和溴氢化物性质的热稳定性:HCl>HBr
c 原子半径:S<Cl
d 酸性:H2SO4<HClO
(4)K的变化体现出X2化学性质的递变性,用原子结构解释X2得电子能力变化的原因______。