题目内容
17.在加热情况下,用足量CO还原7g铁的氧化物组成的混合物,产生气体全部通入足量石灰水中得到12.5g沉淀,此混合物不可能为( )| A. | FeO、Fe2O3 | B. | FeO、Fe3O4 | C. | Fe2O3、Fe3O4 | D. | FeO、Fe2O3、Fe3O4 |
分析 12.5g沉淀为碳酸钙,根据n=$\frac{m}{M}$计算碳酸钙物质的量,进而计算二氧化碳的物质的量,CO获得氧化物中O原子转化为CO2,据此计算氧化物中氧原子物质的量,进而计算Fe原子物质的量,根据Fe、O原子数目之比判断.
解答 解:12.5g沉淀为碳酸钙,其物质的量为$\frac{12.5g}{100g/mol}$=0.125mol,由碳元素守恒可知,二氧化碳的物质的量为0.125mol,CO获得氧化物中O原子转化为CO2,故氧化物中n(O)=n(CO2)=0.125mol,则m(O)=0.125mol×16g/mol=2g,故氧化物中n(Fe)=$\frac{7g-2g}{56g/mol}$=$\frac{5}{56}$mol,则n(Fe):n(O)=$\frac{5}{56}$mol:0.125mol=5:7=1:1.4,
A.n(Fe):n(O)介于1:1.5~1:1之间,符合题意,故A不选;
B.n(Fe):n(O)介于1:1.33~1:1之间,不符合题意,故B选;
A.n(Fe):n(O)介于1:1.5~1:33之间,符合题意,故C不选;
A.n(Fe):n(O)介于1:1.5~1:1之间,符合题意,故D不选,
故选B.
点评 本题考查混合物反应有关计算,根据守恒法计算Fe、O原子数目之比,再结合极限法判断,侧重考查学生分析计算能力,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.对下面有机物的叙述不正确的是( )
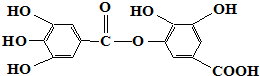

| A. | 常温下可以和Na2CO3溶液反应生成CO2气体 | |
| B. | 在碱性条件下水解,0.5mol该物质完全反应可以消耗4mol NaOH | |
| C. | 与稀H2SO4共热生成两种不同的有机物 | |
| D. | 该物质的化学式为C14H10O9 |
8.下列离子方程式书写正确的是( )
| A. | 硫酸铜溶液与氢氧化钡溶液混合:Cu2++2 OH-=Cu(OH)2↓ | |
| B. | 用小苏打(NaHCO3)治疗胃酸(主要成分是盐酸)过多:CO32-+H+═CO2↑+H2O | |
| C. | 将少量二氧化碳气体通入澄清石灰水中:2OH-+CO2═CO32-+H2O | |
| D. | 稀硫酸与氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓ |
5.下列仪器中,能在酒精灯火焰上直接加热的玻璃仪器是( )
| A. | 试管 | B. | 蒸发皿 | C. | 烧杯 | D. | 蒸馏烧瓶 |
9.体积为V(mL)、密度为ρ(g/cm3)的溶液中,含有摩尔质量为M(g/mol)的溶质m(g),其物质的量浓度为c(mol/L),溶质的质量分数为a%.下列有关关系式不正确的是( )
| A. | m=Vρa% | B. | c=1000ρaM | C. | c=$\frac{1000m}{VM}$ | D. | a%=$\frac{cM}{1000ρ}$×100% |
6.下列叙述正确的是( )
| A. | 直径介于1nm~100 nm之间的微粒称为胶体 | |
| B. | 电泳现象可证明胶体带电 | |
| C. | 用盐析法可分离皂化反应后所得的产物 | |
| D. | 用含1mol FeCl3的溶液可制得6.02×1023个Fe(OH)3胶体粒子 |
