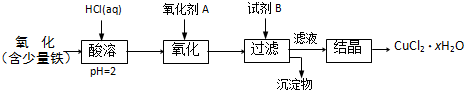
题目内容
在某化工生产中要用一种无色、可溶于水的晶体 铝铵矾.该晶体是一种复盐,其主要化学成分为十二水合硫酸铝铵.向该复盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化.已知
铝铵矾.该晶体是一种复盐,其主要化学成分为十二水合硫酸铝铵.向该复盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化.已知 与
与 在水溶液中不能大量共存,会发生如下反应:
在水溶液中不能大量共存,会发生如下反应: +
+ +H2O
+H2O Al(OH)3↓+NH3↑.
Al(OH)3↓+NH3↑.
试回答:
(1)在硫酸铝铵水溶液中滴入石蕊试液,观察到的现象是________,其原因是________.
(2)在逐滴加入浓NaOH溶液的过程中,产生的现象有:①出现白色沉淀;②有刺激性气味的气体逸出;③白色沉淀量逐渐增多;④白色沉淀完全消失;⑤白色沉淀量逐渐减少.回答出各种现象由先到后出现的顺序(用序号回答):________→________→________→________→________.
(3)写出滴入NaOH溶液的过程中,有关反应的离子方程式:①________;②________;③________.
解析:
|
(1)溶液呈红色, 【巧解导析】该复盐为可溶性强电解质,溶于水发生如下电离:NH4Al(SO4)2·12H2O |
提示:
|
【巧解点悟】解题关键点:抓住Al(OH)3的两性,准确判断逐渐滴加NaOH时,依次发生的化学反应.易错点:将依次发生的化学反应弄混淆. |

 +H2O
+H2O NH3·H2O+H+,Al3++3H2O
NH3·H2O+H+,Al3++3H2O Al(OH)3↓,②
Al(OH)3↓,② +2H2O
+2H2O +12H2O.
+12H2O.
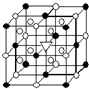 A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子
A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子