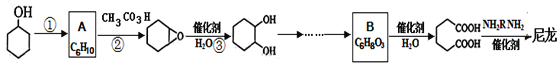
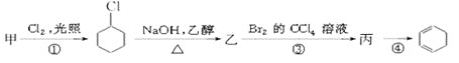
题目内容
【题目】磷和砷是同主族的非金属元素。
(1)砷(As)元素位于元素周期表第____列;As原子能量最高的3个轨道在空间相互____;1个黄砷(As4)分子中含有_____个As﹣As键,键角_____度.
(2)黑磷的结构与石墨相似.最近中国科学家将黑磷“撕”成了二维结构,硬度和导电能力都大大提高,这种二维结构属于____(选填编号).
a.离子晶体 b.原子晶体 c.分子晶体 d.其它类型
(3)与硫元素的相关性质比,以下不能说明P的非金属性比S弱的是_____(选填编号).
a.磷难以与氢气直接化合 b.白磷易自燃 c.P﹣H的键能更小 d.H3PO4酸性更弱
(4)次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍﹣磷合金.
化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性条件下发生以下镀镍反应:
___ Ni2++___ H2PO2﹣+___H2O →____Ni+____ H2PO3﹣+___H+
①请配平上述化学方程式。
②上述反应中,若生成1mol H2PO3﹣,反应中转移电子的物质的量为______。
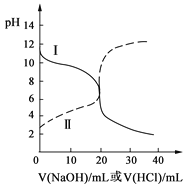
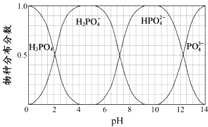
(5)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。
①pH=8时,溶液中主要含磷物种浓度大小关系为_________________。
②为获得尽可能纯的NaH2PO4,pH应控制在______________________________。
【答案】15 垂直 6 60 d b 1 1 1 1 1 2 2mol c(HPO42﹣)>c(H2PO4﹣) 4~5.5(介于此区间内的任意值或区间均可)
【解析】
(1)砷(As)为第ⅤA族元素,As原子能量最高的3个轨道为4p,黄砷(As4)分子类似P4结构,为正四面体;
(2)黑磷的结构与石墨相似,硬度和导电能力都大大提高,则晶体类型与石墨相同;
(3)可利用与氢气化合的难易程度、N-H和P-H的键能及最高价含氧酸的酸性等比较非金属性;
(4)镍元素的化合价降低了2价,磷元素的化合价升高的2价,根据原子守恒结合电荷守恒可得配平的方程式;
(5)为获得尽可能纯的NaH2PO4,pH应控制从图表中找出H2PO4-分布分数最大值所在区间;溶液中主要含磷物种浓度大小关系可由图表得出。
(1)砷(As)为第ⅤA族元素,位于元素周期表第15列,As原子能量最高的3个轨道为4p,在空间相互垂直,黄砷(As4)分子类似P4结构,为正四面体,有6个As﹣As键,键角为60度;
(2)黑磷的结构与石墨相似,硬度和导电能力都大大提高,则晶体类型与石墨相同,存在共价键和分子间作用力,为混合型晶体,故答案为:d;
(3)可利用与氢气化合的难易程度、N﹣H和P﹣H的键能及最高价含氧酸的酸性等比较非金属性,a、c、d均可比较,而b不能,故答案为:b;
(4)①镍元素的化合价降低了2价,磷元素的化合价升高了2价,由电子、电荷守恒及原子守恒可知,离子反应为Ni2++H2PO2﹣+H2O═Ni+H2PO3﹣+2H+;
②1mol H2PO3﹣,反应中转移电子的物质的量为1mol×(4﹣2)=2mol;
(5)①由图可知,pH=8时,溶液中主要含磷物种浓度大小关系为c(HPO42﹣)>c(H2PO4﹣);
②为获得尽可能纯的NaH2PO4,pH应控制从图表中找出H2PO4﹣分布分数最大值所在区间,即4~5.5(介于此区间内的任意值或区间均可)。

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】CO和H2可作为能源和化工原料,应用十分广泛。常利用煤气化过程中生成的CO和H2来制备甲醇。
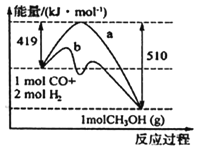
(1)请根据图示写出该反应的热化学方程式:_______________;图中使用催化剂曲线是_______(填“a”或“b”)。
(2)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3 kJ/mol
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)的ΔH=______________kJ/mol。
(3)反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如下表所示。
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
①从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为___________________。
(4)汽车排气管上的催化转化器发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0,在一定温度下,将一定量的NO和CO充入2 L固定容积的容器中,回答以下问题:
N2(g)+2CO2(g) △H<0,在一定温度下,将一定量的NO和CO充入2 L固定容积的容器中,回答以下问题:
①能说明该反应达到平衡状态的是_____________(填字母标号)。
A. 2v正(NO)=v逆(N2) B. 混合气体的平均相对分子质量保持不变
C. 气体总压强不再变化 D. ΔH保持不变
E.混合气体的密度不再变化
②从反应开始到5 min,生成了0.08 mol N2,则5 min内v(CO)=__________mol/(L·min)。
③25 min时,物质浓度变化如图所示,则改变的条件可能是________(填字母标号)。
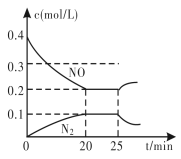
A. 缩小容器体积 B. 增加NO的浓度
C. 降低温度 D. 升高温度