题目内容
【题目】【化学一选修3: 物质结构与性质】
(1)CH3COONH2 分子中各元素第一电离能大小顺序__________,该物质中碳原子杂化方式为_______________________________。
(2)工业制备铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4) 等弱碱。
N2H4 | NH3 | |
熔点/℃ | 2 | -77.8 |
沸点/℃ | 113.5 | -33.5 |
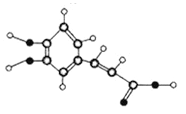
比较上表中氨(NH3)、联氨(N2H4) 的熔、沸点,解释其高低的主要原因________,![]() 的离域π键表示为________________________,与NH3 互为等电子体的阳离子有__________。
的离域π键表示为________________________,与NH3 互为等电子体的阳离子有__________。
(3)浅红色Cr [(H2O)3(NH3)3]Cl3中铬离子价电子排布式为__________________。
(4)SiC具有高硬度,高耐磨性,高耐腐蚀性和较高的高温强度特点,已成为一种重要的工程材料,其晶体具有六方ZnS 型结构。晶胞参数a=308pm,c=505pm,已知C原子的分数坐标(0,0,0)和(![]() ,
,![]() ,
,![]() );Si原子的分数坐标(0,0,
);Si原子的分数坐标(0,0,![]() )和((
)和((![]() ,
,![]() ,
,![]() )
)
①按比例在下框中商出SiC 六方晶胞_______

②列式计算Si-C的键长_______(保留整数部分)
【答案】 N>O>H>C SP3杂化、SP2杂化 联氨分子间形成的氢键数目多于氨分子间形成的氢键 ![]() H3O+ 3d3
H3O+ 3d3  黑球是碳,白球是硅 dsi-c=(1-
黑球是碳,白球是硅 dsi-c=(1-![]() )c=
)c=![]() ×505pm=189pm
×505pm=189pm
【解析】(1)CH3COONH2所含四种元素分别为N、H、C、O,同一主族,从上到下,第一电离能减小,同一周期中,元素的第一电离能随着原子序数的增大呈增大趋势,但是氮元素的2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能大于同周期的相邻元素,所以四种元素第一电离能由大到小的顺序为:N>O>H>C ; CH3COONH2中甲基中的C原子 sp杂化,羧基中的C原子 sp杂化;正确答案:N>O>H>C; sp杂化、sp杂化 。
(2)氨和联氨分子间均存在氢键,但联氨分子间形成的氢键数目多于氨分子间形成的氢键,故联氨的沸点明显高于氨; ![]() 分子中,6个碳的P轨道,每个碳含有1个电子,1个氮的P轨道,含有2个未参与成键的电子,因此大π键中含有的电子数为8,参与形成π键的原子数为7,所以
分子中,6个碳的P轨道,每个碳含有1个电子,1个氮的P轨道,含有2个未参与成键的电子,因此大π键中含有的电子数为8,参与形成π键的原子数为7,所以![]() 的离域π键表示为
的离域π键表示为![]() ;原子数、总电子数均相等的物质,其结构相似,物理性质相近,相应的物质称为等电子体,所以与NH3互为等电子体的阳离子有H3O+;正确答案:联氨分子间形成的氢键数目多于氨分子间形成的氢键;
;原子数、总电子数均相等的物质,其结构相似,物理性质相近,相应的物质称为等电子体,所以与NH3互为等电子体的阳离子有H3O+;正确答案:联氨分子间形成的氢键数目多于氨分子间形成的氢键; ![]() ; H3O+。
; H3O+。
(3)根据化合价法则,Cr[(H2O)3(NH3)3]Cl3中铬为+3价,铬原子核外电子排布为ls22s22p63s23p63d54s1,Cr3+价电子排布式为3d3;
(4)①SiC六方晶胞的轴比c/a=505pm/308pm=1.64,Si原子和C原子的共价半径分别为113 pm和77 pm,参照这些数据和原子的坐标参数,画出SiC的六万晶胞如下图所示: 黑球是碳,白球是硅 ;正确答案:
黑球是碳,白球是硅 ;正确答案: 黑球是碳,白球是硅。
黑球是碳,白球是硅。
②由上图中的晶胞图可知,Si-C键键长为dsi-c=(1-![]() )c=
)c=![]() ×505pm=189pm;正确答案:189pm。
×505pm=189pm;正确答案:189pm。

 每课必练系列答案
每课必练系列答案