题目内容
氯碱工业中电解饱和食盐水的原理示意图如下图所示:
(1)溶液A的溶质是 ;
(2)电解饱和食盐水的离子方程式是 ;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 ;
(4)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42->c(Ca2+)]。精制流程如下(淡盐水和溶液A来自电解池):
①盐泥a除泥沙外,还含有的物质是 。
②过程Ⅰ中将NH4+转化为N2的离子方程式是 ;
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有 。

解析

练习册系列答案
相关题目
图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门。下列说法不正确的是

| A.图Ⅰ中a为纯铜 |
| B.图Ⅰ中SO42—向b极移动 |
| C.图Ⅱ中如果a、b间连接电源,则a连接负极 |
| D.图Ⅱ中如果a、b间用导线连接,则X可以是铜 |
汽车的启动电源常用铅蓄电池,电池反应如下:
PbO2 + Pb + 2H2SO4 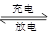 2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
| A.PbO2放电时是电池的负极,充电时是电池的阳极。 |
B.负极的电极反应式为:Pb + SO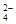 – 2e – = PbSO4 – 2e – = PbSO4 |
| C.放电时,PbO2得电子,被氧化 |
| D.电池放电时,溶液酸性增强 |
甲醇、氧气和强碱溶液做电解质的手机电池中的反应为:
2CH3OH+3O2+4OH-  2CO32-+6H2O,有关说法正确的是
2CO32-+6H2O,有关说法正确的是
| A.放电时,CH3OH参与反应的电极为正极 |
| B.放电时,负极电极反应:CH3OH+8OH--6e- =CO32-+6H2O |
| C.标况下,通入11.2LO2完全反应有1mol电子转移 |
| D.充电时电解质溶液的pH逐渐减小 |
如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2作溶剂,反应原理是4Li+FeS2=Fe+2Li2S。下列说法不正确的是
| A.该装置将化学能转化为电能 |
| B.电子移动方向是由a极到b极 |
| C.可以用水代替SO(CH3)2做溶剂 |
| D.b极反应式是FeS2+4Li++4e-=Fe+2Li2S |
番茄汁显酸性,在番茄上平行地插入铜片和锌片形成一个原电池,如图所示。以下叙述正确的是( )
| A.铜片上发生氧化反应 |
| B.锌片为正极,铜片为负极 |
| C.锌片为阴极,铜片为阳极 |
| D.番茄汁起电解质溶液的作用 |
氯碱工业的基本原理就是电解饱和食盐水。下列关于实验室电解饱和食盐水的说法中正确的是( )
| A.可以选用石墨棒作为阴、阳极材料,但阳极材料也可以用铁棒 |
| B.用湿润的淀粉KI试纸靠近阴极区域,试纸变蓝 |
| C.电解过程中,在阳极区域溶液中滴加品红,品红褪色 |
| D.实验结束后,将溶液搅拌,然后用pH试纸检验,溶液呈中性 |
 Li2CoO2,下列说法不正确的是
Li2CoO2,下列说法不正确的是