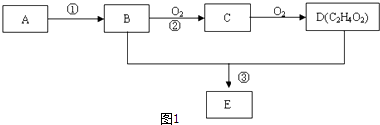
��Ŀ����
����Ŀ�����ΪԪ�����ڱ���һ���֣�
̼ | �� | Y | |
X | �� | Z |
�ش��������⣺
��1��ZԪ�������ڱ��е�λ��Ϊ ��
��2������Ԫ��ԭ�Ӱ뾶�����ǣ���Ԫ�ط��ţ� ��
��3��������ʵ��˵��YԪ�صķǽ����Ա�SԪ�صķǽ�����ǿ���� �� a��Y������H2S��Һ��Ӧ����Һ�����
b����������ԭ��Ӧ�У�1molY���ʱ�1molS�õ��Ӷ�
c��Y��S��Ԫ�صļ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸ�
��4���е㣺H2YH2S���������=���������������� ��
��5��Y2��Y3��Ϊ���ͬλ�ء���ͬ���칹�塱��ͬ�������塱����
��6�����е���Y2��������ͼ��ʾװ�ã�ȼ�ϵ�أ�������������д��Y2�����Ե������Һ�з����ĵ缫��Ӧ����ʽ �� 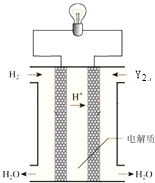
���𰸡�
��1���������ڡ��ڢ�A��
��2��Si
��3��ac
��4������H2O���Ӽ������������ȷ��Ӽ�������ǿ
��5��ͬ��������
��6��O2+4e��+4H+=2H2O
���������⣺��Ԫ�������ڱ���λ�ÿ�֪��XΪSi��YΪO��ZΪCl����1��ZΪCl��λ�����ڱ��е������ڡ��ڢ�A�壬���Դ��ǣ��������ڡ��ڢ�A�壻��2�����Ӳ�Խ�࣬ԭ�Ӱ뾶Խ��ͬ���ڴ�������ԭ�Ӱ뾶��С��������Ԫ����Si��ԭ�Ӱ뾶������Դ��ǣ�Si����3��a��Y������H2S��Һ��Ӧ����Һ����ǣ���Y�ĵõ���������ǿ��Y�ķǽ�����ǿ������aѡ�� b����������ԭ��Ӧ�У�1molY���ʱ�1molS�õ��Ӷ࣬�õ��Ӷ��ٲ��ܱȽϷǽ����ԣ���b��ѡ��
c��Y��S��Ԫ�صļ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸߣ���֪Y���⻯���ȶ�����Y�ķǽ�����ǿ����cѡ��
���Դ��ǣ�ac����4���е㣺H2Y��H2S��������H2O���Ӽ������������ȷ��Ӽ�������ǿ��
���Դ��ǣ�����H2O���Ӽ������������ȷ��Ӽ�������ǿ����5��Y2��Y3��Ϊͬ�������壬���Դ��ǣ�ͬ�������壻��6��O2�����Ե������Һ�еõ���������ˮ��������ԭ��Ӧ��������ӦΪO2+4e��+4H+=2H2O��
���Դ��ǣ�O2+4e��+4H+=2H2O��

����Ŀ����1����ѧƽ�ⳣ��K��ʾ���淴Ӧ�Ľ��г̶ȣ�KֵԽ��ʾ�� Kֵ��С���¶ȵĹ�ϵ�ǣ��¶����ߣ�Kֵ ������һ������һ����С�����������Ҳ���ܼ�С����
��2����һ���Ϊ10L�������У�ͨ��һ������CO��H2O����850��ʱ�������·�Ӧ��CO��g�� +H2O��g�� ![]() CO2��g�� +H2 ��g�� ��H<0��CO��H2OŨ�ȱ仯����ͼ����0��4min��ƽ����Ӧ����v��CO����mol��L-1��min-1��t��ʱ����Ũ����mol��L-1���ı仯��
CO2��g�� +H2 ��g�� ��H<0��CO��H2OŨ�ȱ仯����ͼ����0��4min��ƽ����Ӧ����v��CO����mol��L-1��min-1��t��ʱ����Ũ����mol��L-1���ı仯��
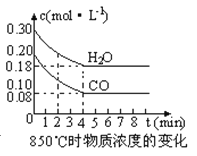
ʱ����min�� | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
��3��t��������850����ʱ������ͬ�����з���������Ӧ�������ڸ����ʵ�Ũ�ȱ仯���ϱ���
�ٱ���3min��4min֮�䷴Ӧ���� ״̬��c 1��ֵ 0.08 mol��L-1 ������ڡ�С�ڻ��������
�ڷ�Ӧ��4min��5min�䣬ƽ�����淽���ƶ������ܵ�ԭ���� ����ѡ��������5min��6min֮����ֵ�����仯�����ܵ�ԭ���� ����ѡ����
a������ˮ���� b�������¶� c��ʹ�ô��� d����������Ũ��