题目内容
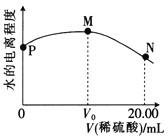
【题目】甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备。甲醛与气态甲醇之间转化的能量关系如图所示。

(1)甲醇催化脱氢转化为甲醛的反应是_______(填“吸热”或“放热”)反应;
(1)过程Ⅰ与过程Ⅱ的反应热______(填“相同”或“不同”),原因是___________________________________________________________;
(2)写出甲醇催化脱氢转化为甲醛的热化学方程式
__________________________________________________________;
(3) 甲醇催化脱氢转化为甲醛的过程中,如果要使反应温度维持在700℃,需向体系中通入空气,通过计算确定进料甲醇与空气的物质的量理论比值为___________________________。(假设:H2(g)+1/2O2(g)===H2O(g) ΔH=-a kJ·mol-1,空气中氧气含量为20%)
【答案】吸热相同一个化学反应的反应热仅与反应的始态和终态有关,而与反应的途径无关CH3OH(g)===HCHO(g)+H2(g) ΔH=+(E2-E1) kJ·mol-1n(CH3OH)∶n(空气)=2a∶5(E2-E1)
【解析】
(1)通过图示变化可知,反应物的总能量小于生成物总能量,该反应为吸热反应;相对于过程Ⅰ,过程Ⅱ为降低了反应活化能,加入了催化剂,但是不影响反应的反应热,因为一个化学反应的反应热仅与反应的始态和终态有关,而与反应的途径无关,所以过程Ⅰ与过程Ⅱ的反应热相同;综上所述,本题答案是:吸热,相同 ,一个化学反应的反应热仅与反应的始态和终态有关,而与反应的途径无关。
(2) 通过图象可以看出,反应物的总能量比生成物的总能量低,故为吸热反应,反应热=生成物总能量-反应物的总能量=(E2-E1) kJ·mol-1,甲醇催化脱氢转化为甲醛的热化学方程式:CH3OH(g)===HCHO(g)+H2(g) ΔH=+(E2-E1) kJ·mol-1 ;综上所述,本题答案是:CH3OH(g)===HCHO(g)+H2(g) ΔH=+(E2-E1) kJ·mol-1。
(3) 反应维持在一定温度持续进行,应保证反应:H2(g)+1/2O2(g)===H2O(g) ΔH=-a kJ·mol-1,放出的热量恰好被反应CH3OH(g)=CH2O(g)+H2(g) ΔH=+(E2-E1) kJ·mol-1全部利用,即CH3OH反应吸收的热量等于氢气燃烧放出的热量,设需甲醇的物质的量为n(CH3OH),需氧气的物质的量为n(O2),则有: n(CH3OH)×(E2-E1)= n(O2)×2×a,计算得出:甲醇与氧气的物质的量之比n(CH3OH):n(O2)= 2a:(E2-E1),根据空气中氧气的体积分数0.2,即可得出n(CH3OH):n(空气)= 2a:5(E2-E1);因此本题答案是:n(CH3OH)∶n(空气)=2a∶5(E2-E1)。

【题目】海洋资源的利用具有广阔前景。
(1)下图是从海水中提取镁的简单流程。
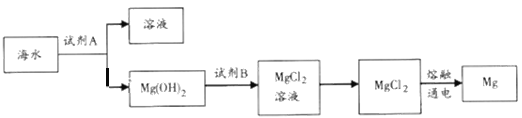
①工业上常用于沉淀Mg2+的试剂A是__________(填化学式),Mg(OH)2转化为MgCl2的离子方程式为________________________。
②由无水MgCl2制取Mg的化学方程式是______________________。
(2)海带灰中富含以I-形式存在的碘元素,实验室提取I2的途径如下所示:
![]()
①灼烧海带至灰烬时所用的主要仪器是__________(填名称);
②向酸化的滤液中加过氧化氢溶液,该反应的离子方程式为__________;
③反应结束后,加入CCl4作萃取剂,采用萃取-分液的方法从碘水中提取碘,主要操作步骤如下图:
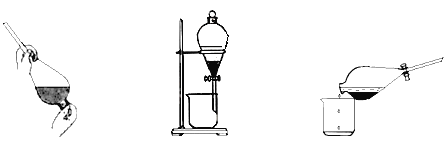
甲.加入萃取剂后振荡 乙.静置分层 丙.分离
甲、乙、丙3步实验操作中,错误的是__________(填“甲”、“乙”或“丙”)。
(3)海水中部分离子的含量如下:
成分 | 含量(mg/L) | 成分 | 含量(mg/L) |
Na+ | 10560 | Cl- | 18980 |
Mg2+ | 1272 | Br- | 64 |
Ca2+ | 400 | SO42- | 2560 |
若从100L该海水中提取镁,理论上需加入试剂A__________g。