题目内容
【题目】某兴趣小组在实验室模拟反应PCl3+SO2+Cl2![]() POCl3+SOCl2制备重要的化工原料
POCl3+SOCl2制备重要的化工原料![]() 。
。
已知:![]() 熔点
熔点![]() ,沸点
,沸点![]() ,遇水极易水解,易与
,遇水极易水解,易与![]() 反应;
反应;
![]() 熔点
熔点![]() ,沸点
,沸点![]() ,遇水强烈水解,能溶于
,遇水强烈水解,能溶于![]() 。
。
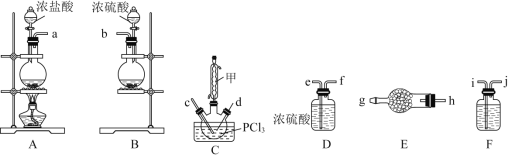
(1)装置A中发生反应的离子方程式是________。
(2)以上各仪器接口的连接顺序是![]() ________
________![]() ________
________![]() ________
________![]() ________
________![]() ,装置E、F中所装的试剂分别是________、________。
,装置E、F中所装的试剂分别是________、________。
(3)装置C制备![]()
①仪器甲的作用是________________________________;
②反应温度控制在![]() ,其原因是________________________________;
,其原因是________________________________;
③SOCl2发生水解反应的化学方程式是________________________________。
(4)产品含杂质![]() ,通过佛尔哈德法可测定
,通过佛尔哈德法可测定![]() 的含量:称取
的含量:称取![]() 样品在碘量瓶中完全水解,将水解液配制成100mL,取
样品在碘量瓶中完全水解,将水解液配制成100mL,取![]() 于锥形瓶中,加入
于锥形瓶中,加入![]() 的
的![]() 溶液
溶液![]() ,再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入
,再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入![]() 指示剂,用
指示剂,用![]() 溶液滴定过量的
溶液滴定过量的![]() 至终点,做平行实验,平均消耗KSCN溶液
至终点,做平行实验,平均消耗KSCN溶液![]() 。
。![]() 已知:
已知:![]() ,
,![]()
①将水解液配成100mL,需用的玻璃仪器除了玻璃棒、烧杯外,还有________;
②若无硝基苯覆盖沉淀表面,测定溶液中![]() 的物质的量将________
的物质的量将________![]() 填“偏大”、“偏小”、“无影响”
填“偏大”、“偏小”、“无影响”![]() ;
;
③POCl3的物质的量分数为________。
![]() 已知:
已知:![]() ,
,![]()
【答案】![]()
![]()
![]()
![]() j e f 无水
j e f 无水![]() 或
或![]() 或硅胶 饱和食盐水
或硅胶 饱和食盐水![]() 或饱和NaCl溶液
或饱和NaCl溶液![]() 冷凝回流
冷凝回流![]() ,提高产率,导气 温度太低,反应速率太慢,温度太高,
,提高产率,导气 温度太低,反应速率太慢,温度太高,![]() 、
、![]() 挥发
挥发 ![]() 或
或![]()
![]() 容量瓶、胶头滴管 偏小
容量瓶、胶头滴管 偏小 ![]()
【解析】
![]() 为制备氯气的装置,据此解答;
为制备氯气的装置,据此解答;
![]() 装置制备氯气,其中混有氯化氢和水蒸气,需要经过F装置中的饱和食盐水除去氯化氢,通过D装置中的浓硫酸干燥,再通入C中,为保证除杂、干燥充分,导气管在洗气瓶中均为长进短出,由装置B制取二氧化硫,需通过E中干燥剂干燥后再通入C中反应,;装置E中为固体干燥剂,装置F是除去氯化氢,据此解答;
装置制备氯气,其中混有氯化氢和水蒸气,需要经过F装置中的饱和食盐水除去氯化氢,通过D装置中的浓硫酸干燥,再通入C中,为保证除杂、干燥充分,导气管在洗气瓶中均为长进短出,由装置B制取二氧化硫,需通过E中干燥剂干燥后再通入C中反应,;装置E中为固体干燥剂,装置F是除去氯化氢,据此解答;
![]() 仪器甲为冷凝管,其作用是冷凝回流,据此解答;
仪器甲为冷凝管,其作用是冷凝回流,据此解答;
![]() 温度过高,
温度过高,![]() 、
、![]() 会大量挥发,导致产量降低,温度过低,反应速率会变慢,据此解答;
会大量挥发,导致产量降低,温度过低,反应速率会变慢,据此解答;
![]() 发生水解反应生成二氧化硫和盐酸,据此解答;
发生水解反应生成二氧化硫和盐酸,据此解答;
![]() 配置溶液需用的玻璃仪器有玻璃棒、烧杯、100mL容量瓶、胶头滴管,据此解答;
配置溶液需用的玻璃仪器有玻璃棒、烧杯、100mL容量瓶、胶头滴管,据此解答;
![]() 硝基苯难溶于水,生成的AgCl沉淀用硝基苯覆盖,目的是防止在滴加KSCN溶液时AgCl沉淀转化为/span>AgSCN沉淀,若无硝基苯覆盖沉淀表面,消耗的KSCN溶液将偏多,测定溶液中
硝基苯难溶于水,生成的AgCl沉淀用硝基苯覆盖,目的是防止在滴加KSCN溶液时AgCl沉淀转化为/span>AgSCN沉淀,若无硝基苯覆盖沉淀表面,消耗的KSCN溶液将偏多,测定溶液中![]() 的物质的量将偏小,据此解答;
的物质的量将偏小,据此解答;
![]() ,沉淀
,沉淀![]() 溶液中
溶液中![]() 消耗的
消耗的![]() 的物质的量为:
的物质的量为:![]() ,
,![]() ,设样品中
,设样品中![]() 的物质的量为x,
的物质的量为x,![]() 的物质的量为y,则:
的物质的量为y,则: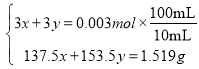 ,据此解答。
,据此解答。
![]() 为制备氯气的装置,发生反应的离子方程式是
为制备氯气的装置,发生反应的离子方程式是![]()
![]()
![]() ,故答案为:
,故答案为:![]()
![]()
![]() ;
;
![]() 装置制备氯气,其中混有氯化氢和水蒸气,需要经过F装置中的饱和食盐水除去氯化氢,通过D装置中的浓硫酸干燥,再通入C中,为保证除杂、干燥充分,导气管在洗气瓶中均为长进短出,由装置B制取二氧化硫,需通过E中干燥剂干燥后再通入C中反应,故连接顺序为
装置制备氯气,其中混有氯化氢和水蒸气,需要经过F装置中的饱和食盐水除去氯化氢,通过D装置中的浓硫酸干燥,再通入C中,为保证除杂、干燥充分,导气管在洗气瓶中均为长进短出,由装置B制取二氧化硫,需通过E中干燥剂干燥后再通入C中反应,故连接顺序为![]() ;装置E中为固体干燥剂,可选用无水
;装置E中为固体干燥剂,可选用无水![]() 或
或![]() 或硅胶,装置F是除去氯化氢,选用饱和食盐水
或硅胶,装置F是除去氯化氢,选用饱和食盐水![]() 或饱和NaCl溶液
或饱和NaCl溶液![]() ,故答案为:
,故答案为:![]() ;j;
;j;
e;f;无水![]() 或
或![]() 或硅胶;饱和食盐水
或硅胶;饱和食盐水![]() 或饱和NaCl溶液
或饱和NaCl溶液![]() ;
;
![]() 仪器甲为冷凝管,其作用是冷凝回流
仪器甲为冷凝管,其作用是冷凝回流![]() ,提高产率,导气,故答案为:冷凝回流
,提高产率,导气,故答案为:冷凝回流![]() ,提高产率,导气;
,提高产率,导气;
![]() 中反应温度控制在
中反应温度控制在![]() ,因为温度过高,
,因为温度过高,![]() 、
、![]() 会大量挥发,导致产量降低,温度过低,反应速率会变慢,故答案为:温度太低,反应速率太慢,温度太高,
会大量挥发,导致产量降低,温度过低,反应速率会变慢,故答案为:温度太低,反应速率太慢,温度太高,![]() 、
、![]() 挥发;
挥发;
![]() 发生水解反应的化学方程式是
发生水解反应的化学方程式是![]() 或
或![]() ,故答案为:
,故答案为:![]() 或
或![]() ;
;
![]() 将水解液配成100mL,需用的玻璃仪器有玻璃棒、烧杯、100mL容量瓶、胶头滴管,故答案为:
将水解液配成100mL,需用的玻璃仪器有玻璃棒、烧杯、100mL容量瓶、胶头滴管,故答案为:![]() 容量瓶、胶头滴管;
容量瓶、胶头滴管;
![]() 硝基苯难溶于水,生成的AgCl沉淀用硝基苯覆盖,目的是防止在滴加KSCN溶液时AgCl沉淀转化为AgSCN沉淀,若无硝基苯覆盖沉淀表面,消耗的KSCN溶液将偏多,测定溶液中
硝基苯难溶于水,生成的AgCl沉淀用硝基苯覆盖,目的是防止在滴加KSCN溶液时AgCl沉淀转化为AgSCN沉淀,若无硝基苯覆盖沉淀表面,消耗的KSCN溶液将偏多,测定溶液中![]() 的物质的量将偏小,故答案为:偏小;
的物质的量将偏小,故答案为:偏小;
![]() ,沉淀
,沉淀![]() 溶液中
溶液中![]() 消耗的
消耗的![]() 的物质的量为:
的物质的量为:![]() ,
,![]() ,设样品中
,设样品中![]() 的物质的量为x,
的物质的量为x,![]() 的物质的量为y,则:
的物质的量为y,则: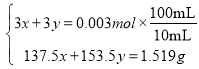 ,解得
,解得![]() ,
,![]() 的物质的量分数为
的物质的量分数为![]() ,故答案为:
,故答案为:![]() 。
。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案