题目内容
【题目】以食盐为原料进行生产并综合利用的某些过程如图。
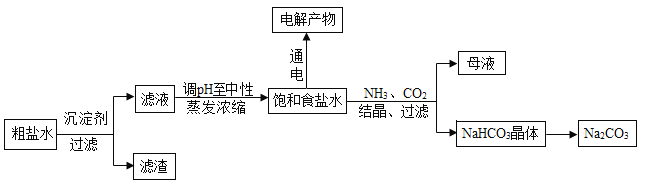
(1) 除去粗盐中的微溶物质CaSO4通常用Na2CO3处理,请用平衡移动原理解释说明:_____________。
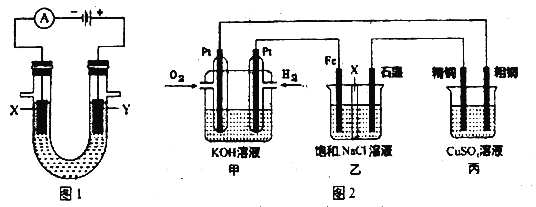
(2) 人们习惯上把电解饱和食盐水的工业叫做氯碱工业.图1表示电解饱和NaCl 溶液的装置,X、Y是石墨棒。实验开始后,检验Y 电极反应产物的方法是_________________。
(3) 若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是__________。
(4) 某同学设计一个燃料电池(如图2所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X 为阳离子交换膜。根据要求回答相关问题:
①通入氢气电极的反应式为__________________。
②反应一段时间后,在乙装置中滴入酚酞溶液,______________(填“铁”或“石墨”)极区的溶液先变红。
③如果粗铜中含有锌、银等杂质,丙装置中反应一段时间后,硫酸铜溶液浓度将___________(填“增大”“减小”或“不变”)。
④若在标准状况下有224mL氧气参加反应,则乙装置中铁电极上生成的气体在标况下体积为_________L。
【答案】 CaSO4存在下列的溶解平衡:CaSO4(s)Ca2+(aq)+SO42﹣(aq),加入Na2CO3溶液后,CO32﹣离子与Ca2+结合,生成更难溶的CaCO3沉淀;Ca2+离子浓度减少,使上述平衡向着更难溶的方向移动 将湿润的KI淀粉试纸放在气体出口,若观察到试纸变蓝,证明有Cl2产生 NH3 H2﹣2e﹣+2OH﹣═2H2O 铁 减小 0.448
【解析】粗盐水加入沉淀剂沉淀Ca2+、Mg2+和SO42-离子,过滤得到滤液,调节溶液pH至酸性,加热浓缩得到饱和氯化钠溶液,电解得到氢氧化钠、氯气和氢气,通入氨气、二氧化碳得到碳酸氢钠晶体,加热分解得到碳酸钠。
(1)CaSO4存在下列的溶解平衡:CaSO4(s)Ca2+(aq)+SO42-(aq),加入Na2CO3溶液后,CO32-离子与Ca2+结合,生成更难溶的CaCO3沉淀;Ca2+浓度减少,使上述平衡向着更难溶的方向移动。
(2)Y电极接电源正极,则Y为阳极,氯离子放电生成Cl2,氯气可以用湿润的淀粉碘化钾试纸检验,如果湿润的淀粉碘化钾试纸变蓝色,则证明有Cl2生成;
故答案为:将湿润的KI淀粉试纸放在气体出口,若观察到试纸变蓝,证明有Cl2产生;
(3)生石灰和水反应生成氢氧化钙且放出热量,氢氧化钙和铵根离子反应生成NH3,所以能循环利用的气体是NH3,
故答案为:NH3;
(4)甲为燃料电池装置,通入燃料H2的电极是负极、通入氧化剂O2的电极是正极;乙和丙装置均为电解池装置,所以Fe为阴极,石墨为阳极,精铜为阴极,粗铜为阳极。
①通入H2的电极是负极,负极失电子,发生氧化反应,电极反应为H22e+2OH═2H2O,
故答案为:H22e+2OH═2H2O;
②甲装置为饱和NaCl溶液的装置,铁电极作阴极,阴极上氢离子放电,同时电极附近有氢氧根离子生成,溶液呈碱性,无色酚酞试液在铁极附近变红色;
故答案为:铁;
③丙装置为粗铜的电解精炼,纯铜为阴极,阴极电极反应为Cu2++2e═Cu,粗铜为阳极,粗铜中含有锌、银等杂质,锌比铜活泼,会先于铜放电,电极反应为:Zn-2e═Zn2+、Cu-2e═Cu2+,所以阳极产生的Cu2+少于阴极减少的Cu2+,导致溶液中硫酸铜浓度降低;
故答案为:减小;
④有224mL氧气即0.01mol氧气参加反应,则电路中转移电子数为0.04mol; Fe电极电极反应为:2H++2e═H2↑,串联电路中转移电子相等,所以氢气的物质的量为0.02mol,体积为0.448L。
故答案为:0.448;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为:
![]()
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是 。
【设计、完成实验】(1)称取 g草酸晶体(H2C2O4·2H2O),配置500 mL 0.10 mol/L H2C2O4溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和 。
②下列操作会使所配溶液浓度偏低的是 (填下列选项的字母序号)。
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘 |
B.定容时俯视刻度线 |
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水 |
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容 |
(2)完成探究,记录数据
实验 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
0.10 mol/L | 等浓度 | H2O | 0.50 mol/L | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | 水浴控制温度65 ℃ | 15 |
3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
4 | 30 | 20 | x | 20 | 加入5 mL 0.10 mol/LK2SO4溶液 | 18 |
则x = ,假设2成立
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定。取10.00 mL 0.10 mol/L H2C2O4溶液于锥形瓶中,加入10 mL 0.50 mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为: 。上述实验中KMnO4溶液的物质的量浓度为 。